Morphologische und biomechanische Eigenschaften des Hüftgelenks (Articulatio coxae) des Hundes (Canis familiaris)
Vorstand: Prof. Dr. Dr. h.c. mult. H.-G. Liebich
Aus dem Institut für Tieranatomie der Tierärztlichen Fakultät der Ludwig-Maximilians-Universität München
Inaugural-Dissertation zur Erlangung der tiermedizinischen Doktorwürde der Tierärztlichen Fakultät der Ludwig-Maximilians-Universität München vorgelegt von Birgit Lieser aus Schongau München 2003
Abkürzungen
| ATW | Antetorsionswinkel |
| CCD | Centrum-Collum-Diaphysenwinkel |
| CT | Computertomograph |
| CT-OAM | Computertomographische Osteoabsorptiometrie |
| DSH | Deutscher Schäferhund |
| DV | Druckversuch |
| FEM | Finite Element Methode |
| HD | Hüftgelenkdysplasie |
| HU | Hounsfield Units |
| Inc. | Incisura |
| KG | Körpergewicht |
| KSL | Knorpelspaltlinien |
| Lig. | Ligamentum |
| m | männlich |
| OA | Osteoarthrose |
| PON | Polnischer Niederungshütehund |
| R | Resultierende |
| Tors | Torsion |
| w | weiblich |
1 Einleitung
Die Entwicklung des Hüftgelenks des Hundes wird entscheidend beeinflusst
durch biomechanische Faktoren (Riser, 1973a). Dies geschieht im Sinne einer
funktionellen Anpassung von Knorpel- und Knochengewebe an seine mechanische
Beanspruchung (Pauwels, 1960). Darüber hinaus gibt es bei entwicklungsbedingten
und degenerativen Gelenkerkrankungen wie z.B. der Hüftgelenkdysplasie
(Riser, 1973b) und der Koxarthrose (Prieur, 1980) biomechanische
Zusammenhänge in ihrer Ätiopathogenese.
Die unüberschaubare Anzahl von Studien in der tiermedizinischen Fachliteratur zur Ätiologie, Pathogenese, Diagnostik und Therapie der Hüftgelenkserkrankungen des Hundes zeugen von der Aktualität des Themenkomplexes. Zahlreiche Studien zur Ätiopathogenese der Hüftgelenkserkrankungen legen eine unphysiologische Biomechanik des Gelenks in unterschiedlichem Ausmaß zugrunde (Alexander, 1992; Cardinet et al., 1997; Fries und Remedios, 1995; Riser, 1973b; Riser et al., 1985; Schawalder et al., 1997, um nur einige zu nennen). Nicht weniger Studien beschäftigen sich mit der Beseitigung unphysiologischer biomechanischer Verhältnisse im Hüftgelenk durch rekonstruktive Operationen wie die intertrochantäre Varisationsosteotomie, die Dreifachbeckenosteotomie, die Pfannendachplastik und den totalen Hüftgelenksersatz (Bartel et al., 1975; Braden und Prieur, 1992; Küpper et al., 1989; Montgomery et al., 1992; Remedios und Fries, 1995; Slocum und Slocum, 1992; Stubbs et al., 1998, u.a.). Dabei gehen alle Studien von einer exakten Passgenauigkeit bzw. physiologischen Kongruenz als Grundlage für eine normale Gelenkfunktion aus. Es wird lediglich eine geringe Abweichung von der Kugelform zugestanden, da das kanine Hüftgelenk nicht vollkommen sphärisch ist (Alexander, 1992; Riser, 1973a; Riser et al., 1985, u.a.).
Dennoch gibt es bisher nur wenige Erkenntnisse über die physiologische Biomechanik und funktionelle Anatomie im gesunden Hüftgelenk des Hundes. Weitergehende Angaben zur Verteilung von Belastung und Beanspruchung an den Gelenkflächen selbst liegen nicht vor.
Ziel der Arbeit ist – aus anatomischer Sicht – die exakte Charakterisierung der langfristigen und momentanen Belastungsverhältnisse im gesunden Hüftgelenk des Hundes. Es wird angestrebt, einen Zusammenhang zwischen morphologischen und biomechanischen Parametern herzustellen und damit einen Beitrag zur angewandten Anatomie zu liefern. Dank eines neuen biomechanischen Ansatzes ist es möglich, erstmals die längerfristigen Belastungsverhältnisse eines Gelenkes durch die Analyse biomechanischer Parameter der Gelenkflächen zu rekonstruieren.
Die Ergebnisse werden mit dem Ziel verfolgt, eine Anregung zur Weiterentwicklung von biomechanisch korrekten Therapien, Hüftendoprothesen und Finite Element Modellen zu geben. Darüber hinaus könnten sie dazu beitragen, die mechanischen Auslöser zu beleuchten, die bei der Entstehung der Osteoarthrose beteiligt sind.
2 Literaturübersicht
2.1 Anatomie des Hüftgelenks, Articulatio coxae
Das Hüftgelenk des Hundes ist ein vielachsiges Kugelgelenk, Articulatio spheroidea.
Ein ideales Kugelgelenk hat drei Hauptebenen der Bewegung. Diese
sind die Sagittalebene (Flexion/ Extension), die Transversalebene (Adduktion/
Abduktion) und die Vertikalebene (Suppination/ Pronation) (Abb. 2.1). Zusätzlich
ist auch eine laterale Translation in neutraler Stellung unter lateromedialer
Zugbelastung möglich (Heyman et al., 1993; Smith et al., 1990).

Abb. 2.1: Bewegungsachsen des Hüftgelenks mit den Rotationsfreiheitsgraden.
Das Hüftgelenk wird gebildet aus der konvexen Gelenkfläche des Oberschenkelkopfes, Caput ossis femoris und der konkaven Hüftgelenkspfanne, dem Acetabulum (lat.: „Essignäpfchen“).
Die anatomische Darstellung bezieht sich allgemein, soweit nicht anders vermerkt, auf folgende Standardwerke der Anatomie: Budras et al. (2000), Dyce et al. (1991), Evans (1993a), Evans (1993b), Liebich und König (2001), Nickel et al. (1992), Seiferle und Frewein (1992), Vollmerhaus et al. (1994a) und Vollmerhaus et al. (1994b).
2.1.1 Os femoris
Das Os femoris ist der proximale Teil der Beckengliedmaße, Stylopodium. Er
stellt den stärksten Knochen des Körpers dar. Das proximale Endstück trägt
das halbkugelförmige Caput ossis femoris, das durch ein Collum deutlich vom
Corpus ossis femoris abgesetzt ist und nach medial vorragt. Seine überknorpelte
Gelenkfläche ist größer als die des Acetabulum, was charakteristisch für den
konvexen Teil von Kugelgelenken ist (Smith, 1963). Das Caput ossis femoris ist
nahezu komplett mit Gelenkknorpel überzogen, mit Ausnahme der Fovea capitis
und einem distal davon liegenden Bereich. Diese Bandgrube liegt auf der
medialen Fläche und dient dem Ansatz des Lig. capitis ossis femoris.
Das Caput ossis femoris ist nur annähernd halbkugelförmig (Shively und Van Sickle, 1982). Es weist rassebedingte Unterschiede in der Ausprägung seiner Form auf (Richter und Loeffler, 1976). Ebenso rasseabhängig mehr oder weniger deutlich wird der Gelenkkopf durch den Femurhals, Collum, vom Femurschaft, Corpus ossis femoris abgesetzt. Demnach besitzen Schäferhund, Boxer und Pudel einen fast halbkugelförmigen Femurkopf, der dem Femurhals breitflächig aufsitzt. Der Teckel hat dagegen eine längsovale Gelenkfläche, die medial deutlich vom Femurhals abgesetzt ist und kappenförmig übersteht. Der Spaniel nimmt eine Zwischenstellung ein. Sein Femurhals ist nicht besonders nach medial abgesetzt, die Gelenkfläche ist eher längsoval (Abb. 2.2).
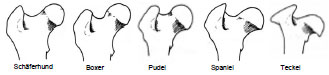
Abb. 2.2: Linkes Os femoris, Kaudalansicht; die Form der Gelenkfläche variiert
rasseabhängig durch eine unterschiedliche Lage des medialen und dorsalen Gelenkrandes
(Abb. nach Richter, 1977).
Der Femurhals geht distal in den Schaft über. Dabei bildet er einen Winkel zum Schaft, den Centrum-Collum-Diaphysenwinkel (CCD), von durchschnittlich 147° (Sterchi, 1980). Darüber hinaus ist der Femurhals individuell unterschiedlich nach kranial gebogen. Den Winkel, den er dabei mit der Femurkondylenachse bildet, ist der Anteversionswinkel (ATW), der durchschnittlich bei 31° liegt (Montavon, 1985; siehe auch Kap. 2.2.4).
Nach lateral schließt sich der große Umdreher, Trochanter major, am proximalen Femurschaft an, der dem Ansatz der Glutaealmuskelgruppe dient. Er ist über einen Knochensteg mit dem lateralen Anteil des Femurhalses verbunden. Dieser stellt die proximale Begrenzung der Fossa trochanterica dar, in der die kleinen Rotationsmuskeln des Beckens ansetzen. Der Trochanter major erreicht beim Hund in der Regel die Höhe des Femurkopfes, bleibt aber bei verschiedenen Hunderassen, wie Schäferhund, Boxer und Pudel unter dieser Höhe (Abb. 2.2). Beim Dackel überragt der Trochanter major den Femurkopf (Richter und Loeffler, 1976).
Kaudal ist der Trochanter major über die Crista intertrochanterica mit dem mediodistal gelegenen Trochanter minor, Ansatzstelle für den M. illiopsoas, verbunden. Am kaudolateralen Rand des Schafts, distal des Trochanter major, kann der Trochanter tertius, der nur beim Pferd als deutlicher Knochenvorsprung ausgebildet ist, bei stark bemuskelten Tieren als Rauigkeit vertreten sein. Hier findet der M. glutaeus superficialis seinen Ansatz.
Weiter distal auf der Kaudalfläche des Femurschafts, der beim Hund nach kranial gebogen ist, befindet sich das Planum trochantericum. Die Facies aspera mit ihrem Labium laterale und mediale und die Facies poplitea folgen distal davon. Jeweils seitlich schließen sich die Tuberositas supracondylaris lateralis und medialis an. Am distalen Gelenkende sitzen dem Femur die Gelenkknorren, Condylus lateralis und medialis, zur Artikulation mit der Tibia im Kniegelenk auf. An ihrer Kaudalfläche tragen sie die Facies articularis sesamoidea lateralis und medialis zur Artikulation mit den Sesambeinen der Ursprungssehnen des Wadenmuskels, M. gastrocnemius. Zwischen den Femurkondylen liegt die Fossa intercondylaris. Seitlich der Kondylen befinden sich jeweils ein Bandhöcker, Epicondylus lateralis et medialis, und Bandgruben. Distal am Condylus lateralis befinden sich die Fossa musculi poplitei und die Fossa extensoria. Kranial trägt das distale Gelenkende die Fossa suprapatellaris und unmittelbar distal davon die Trochlea ossis femoris, die Kniescheibenrolle, die mit der Kniescheibe, Patella, im Femoropatellargelenk artikuliert.
2.1.2 Acetabulum
Das konkave Acetabulum, die Beckenpfanne, hat annähernd die Form einer
Halbkugel. Es ist kaudoventral durch die Incisura acetabuli unterbrochen. Die
mit Gelenkknorpel überzogene Artikulationsfläche ist halbmondförmig und wird
daher Facies lunata genannt. Zentral liegt die Fossa acetabuli. Sie trägt keinen
Gelenkknorpel und zählt daher nicht zur Artikulationsfläche. Die Incisura acetabuli
setzt sich unterhalb des kaudoventralen Anteils der Facies lunata in einer
vom Os ischii gebildeten Furche nach kaudal fort (Evans, 1993b). Die Form der
Beckenpfanne ist der Form des Femurkopfes entsprechend angepasst und variiert
rasseabhängig (Abb. 2.3).
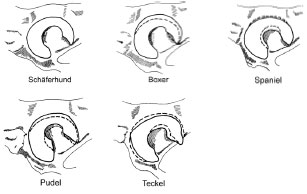
Abb. 2.3: Formen des Acetabulum, Lateralansicht des linken Acetabulum; die gestrichelte
Linie gibt die Kontur der Facies lunata des Schäferhundes wieder (Abb. nach Richter, 1977).
Beim Dackel ist das Acetabulum längsoval und reicht nicht so weit nach dorsal wie beim Schäferhund. Bei anderen Hunderassen, bei welchen die Form der Facies lunata annähernd kreisförmig ist, wie z.B. beim Boxer und Pudel, entsprechen sich Längen- und Höhendurchmesser. Der Schäferhund nimmt eine Zwischenstellung zwischen diesen beiden Formvarianten ein (Richter und Loeffler, 1976).
Die Facies lunata ist im kranialen Bereich bei allen Rassen am breitesten ausgebildet, wird im mittleren dorsalen Pfannendach am schmalsten und nimmt im kaudalen Bereich wieder an Breite zu (Evans, 1993b; Richter und Loeffler, 1976). Bei einem mittelgroßen Hund ist das Acetabulum durchschnittlich 1 cm tief und misst 2 cm im Durchmesser. Im kranialen Bereich ist die Facies lunata beim Schäferhund ca. 16 mm tief und im Pfannendach ca. 9 mm breit (Waibl, 1988).
Am vorderen Pfannenrand bildet die höckerige Area m. recti femoris (Muskelhöcker für den Ursprung des M. rectus femoris) die kraniale Begrenzung. Der vordere Pfannenrand beschreibt bei Schäferhund und Pudel einen weichen, nach kaudolateral verlaufenden Bogen, beim Boxer ist er kantiger abgesetzt. Die Area m. recti femoris überragt beim Dackel den vorderen Rand nach lateral. Beim Spaniel verläuft der vordere Pfannenrand flach nach kaudolateral (Abb. 2.4).
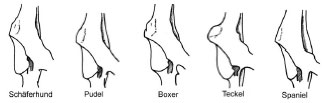
Abb. 2.4: Kontur des kranialen Pfannenrands, Ventralansicht des
rechten Acetabulum (Abb. nach Richter, 1977).
Der kaudale Rand der Facies lunata ist je nach Rasse unterschiedlich geformt. Beim Dackel überragt er sogar den Ramus acetabularis ossis ischii nach ventral (Richter und Loeffler, 1976).
Das Acetabulum entsteht beim Hund entwicklungsgeschichtlich aus vier getrennten Einzelknochen, dem Darmbein, dem Sitzbein, dem Schambein und dem Os acetabuli. Der kraniolaterale Anteil wird vom Darmbeinkörper, Corpus ossis ilii, gebildet, der mittlere Teil vom Schambeinkörper, Corpus ossis pubis, und der kaudolaterale Teil vom Sitzbeinkörper, Corpus ossis ischii. Sie verbinden sich zunächst durch Knorpelfugen im Acetabulum. Das Os acetabuli, ein Knochenkern mit eigenem Ossifikationszentrum, befindet sich zentral zwischen diesen Knochen (Dyce et al., 1991; Evans, 1993b; Nickel et al., 1992). Es verschmilzt im Alter von ca. 8 Wochen mit dem Schambein und später mit Darmund Sitzbein (8-12 Wochen). Im Alter von 4-6 Monaten verknöchern die Einzelknochen vollständig zum einheitlichen Hüftbein, Os coxae. Ein fünftes primäres Ossifikationszentrum, der „T-Pfannendachkern“ bzw. das Os coxae quartum am Pfannendachrand, ist für die Ausbildung des Pfannendachs bzw. die Tiefe der Gelenkpfanne von Bedeutung (Köppel, 1991).
Ventral verbinden sich die Hüftbeine einer jeden Seite in der Symphysis pelvina miteinander. Dorsal besteht eine Verbindung im straffen Iliosakralgelenk mit dem Kreuzbein. Die Darmbeinflügel, Alae ossium ilii, stehen beim Hund fast sagittal und konvergieren leicht nach kranial.
2.1.3 Gelenkaufbau
Das Acetabulum umfasst, zusammen mit seinem fribrokartilaginösen Saum,
dem Labrum acetabulare, den Femur bis zum Äquator. Es ist beim Hund nur
gering ausgebildet und vor allem im Bereich der Inc. acetabuli als Fortsetzung
des Lig. transversum, das den Pfannenrandausschnitt überspannt, deutlich zu
erkennen. Im Gegensatz zum Menschen handelt es sich beim Hüftgelenk des
Hundes nicht um eine Enarthrosis, ein Nussgelenk, bei dem das Caput ossis
femoris über seinen Äquator hinaus umschlossen wird (beschrieben bei Nickel
et al., 1992), sondern um ein Kugelgelenk (Henschel, 1983; vgl. auch Dyce et
al., 1991; Evans, 1993a; Vollmerhaus et al., 1994b).
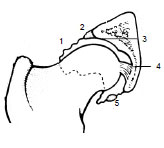
Abb. 2.5: Querschnitt durch das Hüftgelenk (Abb. nach Dyce et al., 1991). 1 Gelenkkapsel, 2 Labrum
acetabulare, 3 Facies lunata, 4 Lig. capitis ossis femoris, 5 Lig. transversum acetabuli.
2.1.3.1 Gelenkkapsel
Die Gelenkkapsel, Capsula articularis, setzt als Fortsetzung des Periosts, proximal
am Rand der Hüftgelenkspfanne und am Collum distal des Femurkopfes
dicht an der überknorpelten Gelenkfläche an. Sie umschließt die Gelenkhöhle,
Cavum articulare, sehr geräumig. Entwicklungsgeschichtlich wird ihre Membrana
synovialis um das Femurkopfband, Lig. capitis ossis femoris, herum angelegt.
Die Kapsel besteht aus zwei Schichten. Die äußere Schicht, Membrana fibrosa, ist eine derbe, fibröse Faserschicht. Die innere Schicht, Membrana synovialis, ist gefäß- und nervenführend. Sie wird innerviert von Rami articulares der vier Plexusnerven N. ischiadicus, N. femoralis, N. glutaeus cranialis und N. obturatoris sowie aus Nervenästen der umgebenden Muskeln und des Periosts (Staszyk und Gasse, 2002). Die Membrana synovialis bildet die Gelenkschmiere, Synovia, die zur Ernährung des gefäßlosen Knorpels dient und die Reibung zwischen den Gelenkknorpelenden herabsetzt.
Der M. articularis coxae strahlt vom kranialen Muskelfortsatz in die Kapsel ein und spannt diese (Budras et al., 2000).
2.1.3.2 Bänder des Gelenks
Am Hüftgelenk des Hundes sind keine Gelenkbänder im herkömmlichen Sinn
vorhanden, die das Gelenk in seiner Bewegung führen. Es wird hauptsächlich
durch die Kapsel, Kapselverdickungen und umgebende Muskeln stabilisiert. Es
finden sich zwei Bänder am Hüftgelenk des Hundes, das Femurkopfband, Lig.
capitis ossis femoris, und das Ergänzungsband, Lig. transversum acetabuli.
Das Lig. capitis ossis femoris verläuft zwischen der Fossa acetabuli des Acetabulum und der Fovea capitis des Femurkopfes. Es ist umgeben von der Membrana synovialis, der Gelenkkapsel. Eine Abspaltung des N. obturatorius (Staszyk und Gasse, 2002) und die A. epiphyisialis (Budras et al., 2000) verlaufen in ihm in Richtung Femurkopf. Die Funktion des Lig. capitis ossis femoris ist weitgehend unklar (Köppel, 1991). Es hat eine bremsende Wirkung bei extremen Torsions-, Ad- und Abduktionsbewegungen. Da es relativ lang ist (1- 1,5 cm), kann ihm, mit Ausnahme der ersten Lebenswochen (Riser, 1973a), keine Haltefunktion zugeschrieben werden (Henschel, 1983; Köppel, 1991; Smith et al., 1990). Es liegt in einer Schleife über der Fossa acetabuli und lässt sich erst nach Eröffnung des Hüftgelenks komplett entfalten. Von daher könnte es auch eine stoßbrechende Funktion haben, entsprechend dem bindegewebigen Pulvinar acetabulare beim Menschen (Köppel, 1991). Man vermutet ebenso eine Rolle in der Gefäßversorgung des Caput ossis femoris, da in ihm bis zum Ende der Wachstumsphase die A. epiphysialis verläuft (Budras et al., 2000; Köppel, 1991).
Das zweite Band des Hüftgelenks, das Lig. transversum acetabuli, verbindet die Spitzen der Facies lunata und überbrückt die Inc. acetabuli. Diese wird dadurch nahezu komplett verschlossen. Das Lig. transversum hält somit das Femurkopfband in seiner Lage (Nickel et al., 1992).
2.1.4 Gelenkknorpel
Der hyaline Gelenkknorpel hat eine glatte, weiß-bläulich schimmernde Oberfläche.
Seine Dicke beträgt wenige Millimeter. Er ist in einer dünnen verkalkten
Zone fest verwachsen mit der unter ihm liegenden subchondralen Knochenplatte.
Der Gelenkknorpel baut sich aus einem System von Kollagenfaserbündeln
auf, die in der Richtung der bei seiner Belastung auftretenden stärksten Zugspannungen
angeordnet sind (Nickel et al., 1992). Er hat eine stoßbrechende
Funktion und eine hohe Widerstandsfähigkeit gegenüber Druck. Seine Elastizität
ermöglicht die Anpassung der Gelenkenden aneinander unter Belastung
(Nickel et al., 1992).
Gelenkknorpel ist in vivo hohen Kompressionskräften ausgesetzt (Muir, 1995). Diesen begegnet er mit seinem komplexen Aufbau. Die Anordnung von festen und flüssigen Bestandteilen ergänzen sich mit den besonderen biochemischen Eigenschaften der Makromoleküle sowie der daraus resultierenden Bewegung von Wasser und Ionen während der physiologischen Belastung (Mow et al., 1980; Muir, 1995). Hyaliner Gelenkknorpel besteht zu 70-80% aus Wasser und nur zu 20-30% aus festen Bestandteilen (Mow et al., 1980; Muir, 1995). Wechselwirkungen zwischen der festen und der flüssigen Phase geben ihm seine besondere viskoelastische Belastungsfähigkeit gegenüber Kompression (Setton et al., 1993).
Gelenkknorpel besteht aus den reifen Knorpelzellen, den Chondrozyten, und der Interzellularsubstanz der Matrix, die von den unreifen Knorpelzellen, den Chondroblasten, gebildet wird.
Die Chondrozyten sind hochdifferenzierte mesenchymale Zellen mit einer eiförmigen untypischen Form. Sie liegen in Lakunen einzeln oder zusammen gelagert in Chondronen in der Interzellularsubstanz (Liebich, 1999; Muir, 1995). Sie sind druckwiderstandsfähige, flüssigkeitsgefüllte Blasen, die mechanische, osmotische und physikalisch-chemische Veränderungen bei dynamischer Belastung dämpfen. Ihre Längsachsen liegen parallel zum einwirkenden Kraftvektor (Muir, 1995).
Die Matrix ist ein aus Wasser und Makromolekülen bestehendes Gel, das durch ein Kollagenfasernetz verstärkt wird. Die Belastungsfähigkeit des Knorpels hängt in erster Linie von der extrazellulären Matrix ab (Hayes und Bodine, 1978). Ihr Aufbau wird durch das Kollagenfasernetzwerk strukturiert. Es werden vier histologische Zonen unterschieden. Die oberflächlichste Schicht, Tangentialfaserschicht oder Zona superficialis, dient als Gleitlager. In ihr verlaufen die Kollagenfasern und flachen Knorpelzellen in dichten Bündeln tangential zur Oberfläche. In der darunter liegenden Übergangschicht verlaufen die Knorpelzellen und Kollagenfasern in verschiedenen Richtungen. In der Zona intermedia, der breiten Radiärfaserschicht, ändern die Kollagenfasern bogenförmig die Richtung in eine radiäre, arkadenförmige Anordnung. Sie durchlaufen die Grenzlinie, „tidemark“, zwischen unkalzifiziertem und kalzifiziertem Knorpel und verankern sich senkrecht wie Arkaden (Benninghoff, 1925b) in der tiefsten Schicht, der Zona profunda oder Verkalkungszone. Diese ist mineralisiert und fest mit dem darunter liegenden Knochengewebe verschmolzen (Arokoski et al., 1999; Budras et al., 2000; Hultkrantz, 1898; Liebich, 1999; Mankin, 1985; Mow et al., 1980; Muir, 1995; Vollmerhaus et al., 1994b). Die Zugfestigkeit des Knorpelgewebes ist proportional abhängig vom Kollagenfasergehalt (Athanasiou et al., 1995).
Im Kollagenfasernetzwerk der Matrix sind die Proteoglykane fest verankert. Proteoglykane sind Makromoleküle mit einem flaschenbürstenförmigen Aufbau. In der Mitte befindet sich ein Kernprotein, an dem seitlich ca. 100 Chondroitinsulfatketten (Glykosaminoglykane; Chondroitin-4-Sulfat, Chondroitin-6-Sulfat) und 30 Keratinsulfatketten hängen. Stabilisiert wird das Molekül durch Bindungen mit Hyaluronsäure und kleineren Glykoproteinen (Mow et al., 1980; Muir, 1995). Verbindungen aus mehreren Proteoglykanen sind so groß, dass sie im kollagenen Netzwerk immobilisiert sind. Sulfatierungen der Moleküle produzieren eine negative Ladung im Netzwerk, so dass durch die anorganischen Gegenionen ein starker osmotischer Druck aufgebaut wird. Als Folge steht Knorpelgewebe unter einer konstanten inneren Spannung. Daher zeigt Knorpel auch einen Hang zum Quellen, was aber normalerweise durch das kollagene Netzwerk unterbunden wird. Bei Belastung finden vorübergehende Änderungen im osmotischen und hydrostatischen Druck statt, wenn Flüssigkeit vom belasteten Bereich entlang eines direkten Druckgradienten zum unbelasteten Abschnitt gedrängt wird. Die Proteoglykane sind jedoch immobil und sorgen für einen Rückstrom der Interzellularflüssigkeit nach Beendigung der Belastung entlang eines osmotischen Gradienten (Hayes und Bodine, 1978; Muir, 1995).
Bei Belastung wird der Druck zuerst von der flüssigen Phase getragen. Wenn die Flüssigkeit durch die Poren der festen Phase verdrängt wurde, verteilt sich die Last über das Proteoglykan-Kollgenfasernetzwerk, bis dieses allein die ganze Last trägt. Auf diese Art und Weise wird die feste Matrix für 100- 200 Sekunden vor ca. 90% der Last bewahrt (Ateshian et al., 1994).
Die Druckfestigkeit hängt proportional vom Proteoglykangehalt (Athanasiou et al., 1995) und umgekehrt proportional vom Wassergehalt des Knorpels ab (Athanasiou et al., 1995). Auf eine Druckbelastung antwortet der Knorpel sofort mit einer elastischen Deformation, die von einem viskösen Kriechverhalten gefolgt wird (Arnold et al., 1978; Mow et al., 1980). Die Rückbildung zur Ausgangsform ist nur dann vollständig, wenn das Knorpelgewebe von Flüssigkeit einer bestimmten Ionenkonzentration (s.o.) umgeben ist (Mow et al., 1980). Diese viskoelastischen Eigenschaften sind wichtig für die Schmierung und Lastübertragung (Hayes und Bodine, 1978).
Nach Vorstellungen der kausalen Histogenese des mesenchymalen Stützgewebes (Pauwels, 1960) kann Gelenkknorpel nur da erhalten bleiben, wo es unter einer auf das Gelenk einwirkenden Druckkraft zur intermittierenden Deformation, „Walkung“, der Knorpelzellen kommt. Diese Deformation darf weder einen Maximalwert über- noch einen Minimalwert unterschreiten, da es sonst zur Differenzierung von Knochengewebe oder Faserknorpel kommt.
2.1.5 Beweger des Hüftgelenks – Myologie
Das Hüftgelenk wird durch seine oberflächlichen und tiefen Muskelgruppen stabilisiert.
Gleichzeitig schränkt die Muskulatur aber die Beweglichkeit im Gelenk
ein (Köppel, 1991), so dass nicht die volle Rotationsfreiheit eines Kugelgelenks
genutzt werden kann (Tab. 2.1). Die wichtigsten Hauptbewegungen zur Fortbewegung
stellen Flexion und Extension dar. Aber auch Ab- und Adduktionsbewegungen
spielen eine wichtige Rolle im Bewegungsmuster des Hüftgelenks
des Hundes.
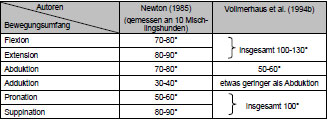
Tab. 2.1: Durchschnittlicher Bewegungsumfang des Hüftgelenks
Im Stand bildet das Hüftgelenk einen Winkel von 126° (109°-146°) beim DSH und 124° (116°-138°) beim Boxer (Lott, 1988).
Für die Bewegung des Hüftgelenks agieren nach Budras et al. (2000), Frewein (1994), Hermanson und Evans (1993), Liebich und König (2001), Manley (1993), Seiferle und Frewein (1992) folgende Muskelgruppen:
Die Glutaealmuskelgruppe bewirkt die Abduktion und wirkt somit während des Ganges dem Körpergewicht entgegen. Daneben hat sie noch die Funktion der Extension und der akzessorischen Einwärtsdrehung (Hermanson und Evans, 1993). Zu ihr gehören der M. glutaeus superficialis, M. glutaeus medius, M. piriformis und der M. glutaeus profundus. Die Glutaeal- oder Kruppenmuskulatur entspringt an der Facies glutaea ossis ilii bzw. am Kreuzbein und Lig. sacrotuberale. Sie inseriert an der Tuberositas glutaea ossis femoris (M. glutaeus superficialis) und am Trochanter major ossis femoris, wo sich eine kleine Bursa synovialis nahe der Ansatzstelle befindet (Hermanson und Evans, 1993).
Die tiefen Hüftgelenksmuskeln („kleine Beckengesellschaft“) repräsentieren eine Gruppe von Muskeln, die kaudal des Hüftgelenks liegen. Ihre Funktion ist die Auswärtsdrehung des Oberschenkels und Streckung des Hüftgelenks, mitunter auch die akzessorische Abduktion, je nach Stellung des Femurs. Dazu gehören der M. obturatorius internus, M. obturatorius externus, die Mm. gemelli und der M. quadratus femoris. Sie entspringen am Hüftbein nahe des For. obturatum bzw. am Tuber ischiadicum und inserieren in der Fossa trochanterica ossis femoris.
Die Adduktoren umfassen die medialen Oberschenkelmuskeln M. gracilis, M. adductor magnus, M. adductor brevis, M. pectineus und M. obturatorius externus. Sie entspringen in der Gegend der Symphysis pelvina und inserieren an der Facies aspera ossis femoris bzw. in der Fascia cruris (M. gracilis).
Die kaudale Oberschenkelmuskulatur, zu der der M. biceps femoris, M. semitendinosus und M. semimembranosus gehören, stellt neben der Glutaealmuskelgruppe die Strecker des Hüftgelenks. Der Ursprung der kaudalen Oberschenkelmuskulatur liegt am Sitzbein und am Lig. sacrotuberale. Sie haben ihren Ansatz distal des Kniegelenks in der Fascia cruris und an der Tibia. Der M. semimembranosus setzt sowohl am Condylus medialis ossis femoris als auch am Condylus medialis tibiae an. Der M. semitendinosus und der M. semimembranosus haben neben einer Extensionsfunktion auch eine Abduktionswirkung im Hangbein.
Zu den Flexoren des Hüftgelenks gehören der M. sartorius, M. tensor fasciae latae, M. illiopsoas, M. articularis coxae und M. rectus femoris. Der M. sartorius entspringt am Tuber coxae und der Crista iliaca und inseriert in der Fascia cruris und an der Crista tibiae. Der M. tensor fasciae latae entspringt ebenfalls am Tuber coxae und inseriert in der Fascia cruris. Der M. iliopsoas hat seinen Ursprung an den letzten Lendenwirbeln und Rippen bzw. am Os Ilium, zieht durch die Lacuna musculorum zum Oberschenkel und setzt dort am Trochanter minor an. Der M. rectus femoris ist ein Anteil des großen M. quadriceps femoris. Er entspringt am Darmbein und hat seinen Ansatz an der Tuberositas tibiae.
2.2 Biomechanik des kaninen Hüftgelenks
Die Literatur zur Biomechanik des kaninen Hüftgelenks begrenzt sich auf eine
überschaubare Anzahl von Artikeln. Theoretische Modelle (Arnoczky und Torzilli,
1981; Prieur, 1980) und Ganganalysen (Dueland et al., 1977) beschäftigten
sich mit der Verteilung der vertikalen und horizontalen Kräfte. Nach wie vor
nimmt der Artikel von Prieur (1980) eine zentrale Stellung in der Diskussion der
Belastung des Hüftgelenks ein. In ihm finden sich die wichtigsten Umsetzungen
von Pauwels Grundlagen der Biomechanik der menschlichen Hüfte (Pauwels,
1973) für den Hund. Viele spätere Forschungsarbeiten bauen auf seinen
Grundlagen auf.
2.2.1 Statische Belastung der Hintergliedmaße
Funktionell gesehen ist das Hüftgelenk ein Teil des Beckengürtels, dessen
Hauptaufgabe es ist, den Vorwärtsschub während der Bewegung von der Hintergliedmaße
über die Verbindung im straffen Iliosakralgelenk auf die Wirbelsäule
zu übertragen (Budsberg et al., 1987; Köppel, 1991; Seiferle und Frewein,
1992). Die Hintergliedmaßen sind als Stemm- und Wurfhebelwerk für die Vorwärtsbewegung
konstruiert. Sie sind daher stärker gewinkelt und bemuskelt als
die Vordergliedmaßen (Seiferle und Frewein, 1992).
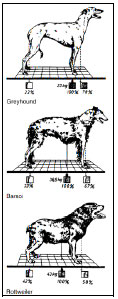
Abb. 2.6: Rasseabhängige Lage des Schwerpunkts und die davon abhängige Verteilung
\ der Körperlast auf Vorderund Hinterhand (Abb. nach Larché, 1962).
Die Hinterhand trägt im Stand nur ca. 30% (Küpper, 1980; Prieur, 1980) bis 40% (Köppel, 1991) des Körpergewichts, in Abhängigkeit von der Lage des Körperschwerpunkts (Abb. 2.6). Je weiter kaudal sich der Schwerpunkt befindet, desto mehr Körpergewicht lastet auf der Hintergliedmaße. Die Lage des Schwerpunkts unterliegt rassetypischen Schwankungen. Zu den stark vorderlastigen Rassen gehören Boxer, Greyhound und Whippet, bei welchen ca. 76- 79% des Körpergewichts auf der Vordergliedmaße liegen. Bei weniger vorderlastigen Rassen wie Rottweiler, Pudel, Schäferhund, Dobermann, Deutsch Drahthaar und Terrier wird die Vordergliedmaße mit nur 58-68% belastet. Auch bei übergewichtigen Tieren verlagert sich der Schwerpunkt nach kaudal (Larché, 1962).
2.2.2 Dynamische Belastung des Hüftgelenks
Bei der Lokomotion werden die Gelenke einer Hintergliedmaße gestreckt und
deren Abstemmen gegen den Boden eingeleitet. Der bodenwärts gerichtete
Druck wird in einen nach vorne gerichteten Schub umgewandelt, der sich über
das Becken und das Iliosakralgelenk auf den Rumpf überträgt. Der Körperschwerpunkt
erfährt eine Verschiebung. Die Hintergliedmaße, die den Schub
ausgelöst hat, schwingt nach vorne, während die diagonale Vordergliedmaße
sich vom Boden abhebt (Seiferle und Frewein, 1992). Die auf das Hüftgelenk
wirkende Kraft in der Bewegung ist ungleich größer als im Stand.
Die Kräfte, die auf das Hüftgelenk wirken, können in eine vertikale und eine horizontale Komponente unterteilt werden. Der vertikale Anteil ist überwiegend bedingt durch die Gewichtskraft, der horizontale Anteil repräsentiert zum größten Teil die vorwärtstreibende Kraft (Dueland et al., 1977; Prieur, 1980).
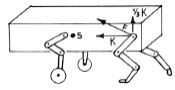
Abb. 2.7: Horizontale und vertikale Kräfte, die durch die Last des Körpergewichts (K) auf das
Hüftgelenk wirken, F = Summenvektor (Abb. nach Prieur, 1980).

Abb. 2.8: Beim schnellen Galopp ist die Kraft überwiegend
horizontal gerichtet (Abb. nach Prieur, 1980).
Ganganalysen des Hundes ergaben, dass die Hintergliedmaßen auch in der Bewegung höchstens 40% des Körpergewichts tragen (Budsberg et al., 1987; Page et al., 1993). Biokinematische Untersuchungen ermittelten die Gelenkwinkelstellung und Phasen des Ganges (Adrian et al., 1966; Allen et al., 1994; De- Camp et al., 1993). Biokinetische Studien bestimmten die Bodenreaktionskräfte (Budsberg et al., 1987; Dueland et al., 1977; Hutton et al., 1969). Dabei wurden mittels Bodenkraftmessplatten die Richtung und Größe der Kraft während des Auffußens der Gliedmaßen ermittelt.
In kombinierten Ganganalysen zeigte sich, dass die dynamische Belastung während des Ganges dann am größten ist, wenn die Last während der mittleren Standbeinphase auf nur einem Hinterbein liegt. Die entstehenden Bodenreaktionskräfte geben einen ersten Eindruck der Belastung der Gliedmaße. So wurden beispielsweise während des Schrittes Bodenreaktionskräfte in Höhe des 0,8fachen Körpergewichts (Hutton et al., 1969) ermittelt. Die Belastung nimmt mit zunehmender Geschwindigkeit bis zum 1,1fachen des Körpergewicht zu (Dueland et al., 1977). Unter klinischen Gesichtspunkten geben vor allem präund postoperative Ganganalysen wertvolle Hinweise auf den Erfolg von orthopädischen Eingriffen (Dogan et al., 1989; Dueland et al., 1977; Hutton und England, 1969; Off und Matis, 1997a; Off und Matis, 1997b).
Ganganalysen mit instrumentierten Hüftendoprothesen (Bergmann et al., 1984; Page et al., 1993) lieferten direkte Daten zur Größe und Richtung der Kräfte, die auf das Hüftgelenk wirken. Mit diesen speziellen Endoprothesen und gleichzeitiger Analyse der Bodenreaktionskräfte ist es möglich, die Belastung im Hüftgelenk für die verschiedenen Phasen des Ganges in vivo zu ermitteln. Da dies jedoch ein aufwendiges invasives Verfahren darstellt, eignet sich diese Art der Untersuchung nicht für weiterführende Fragestellungen.
Ein zweiter Ansatz ist daher, die Kräfte im Hüftgelenk theoretisch über zweidimensionale (Arnoczky und Torzilli, 1981; Badoux und Hoogeveen, 1976; Prieur, 1980; Weigel und Wasserman, 1992) und dreidimensionale (Shahar und Banks-Sills, 2002) Modelle zu berechnen. Aus Längen- und Winkelmaßen der beteiligten Strukturen lassen sich durch Vereinfachungstechniken die Größe und Richtung der Hüftgelenkskräfte berechnen. Darüber hinaus existieren ausführliche morphometrische Studien, die Muskellängen (Badoux und Hoogeveen, 1976; Shahar und Milgram, 2001) und Winkelungen am proximalen Femurende und der Hüftpfanne (Löer, 1999; Mahringer, 1991; Montavon, 1992; Schawalder et al., 1996; Sterchi, 1980) im Hinblick auf ihre biomechanische Eigenschaften untersuchten.
2.2.2.1 Größe der Gelenkresultierenden R
Die Gelenkresultierende R bei der Fortbewegung ist der Summenvektor aus
vertikaler, transversaler und horizontaler Kraftkomponente. Sie setzt sich zusammen
aus äußerer Belastung und inneren Muskelkräften. Dies sind die Last
des zu tragenden Körperanteils und die Kräfte der Hüftgelenksmuskeln
(Pauwels, 1965). R verläuft durch den Drehpunkt des Hüftgelenks und presst
den Kopf in die Pfanne.
Die Kräfte, die auf das Hüftgelenk wirken, hat Prieur (1980) in einem vereinfachten zweidimensionalen Modell berechnet. Dabei macht er die Belastung des Hüftgelenks nicht nur abhängig vom Körpergewicht, sondern auch von der Länge der Hebelarme am Hüftgelenk und von der Beschleunigung des Hundes.
Die Gliedmaßen werden während des Ganges abwechselnd außerhalb des Körperzentrums belastet. Dadurch entsteht durch die einseitige Last des Körpergewichts medial des Hüftgelenks ein Drehmoment am Becken. Um den Körperschwerpunkt im Gleichgewicht zu halten, muss nach den Grundprinzipien zur Erhaltung des Gleichgewichts der Kräfte (Pauwels, 1973) lateral eine Muskelkraft entgegengesetzt werden. Dies ist Aufgabe der Hüftabduktoren, vor allem der Glutaealmuskulatur, die am Trochanter major ansetzt. Die Strecke zwischen Trochanter major und dem Femurkopfzentrum entspricht der Länge des Hebelarms der Glutaealmuskeln. Der Abstand zwischen Femurkopfzentrum und der Körperachse stellt den Hebelarm des entstehenden Drehmoments dar (Abb. 2.9); dieser ist ca. 2- bis 3-mal länger. Die Kraft, die auf den Femurkopf einwirkt, ist die Summe der Kräfte der Hebelarme. Da der mediale Hebelarm mindestens doppelt so lang ist wie der laterale, muss die Muskelkraft auch mindestens doppelt so groß sein (zweifaches Körpergewicht), um das Gleichgewicht zu halten.
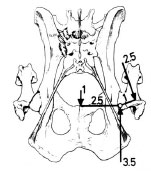
Abb. 2.9: Darstellung der Hebelarme des Hüftgelenks, die Prieur zur Berechnung
der Größe der Belastung im Hüftgelenk verwendet; sie haben einen gemeinsamen Drehpunkt im Femurkopfzentrum,
die Kraft, die auf den Femurkopf einwirkt entspricht dem 3- bis 4fachen Körpergewicht (Abb. nach Prieur, 1980).
Die Drehpunkte beider Hebelarme setzen im Zentrum des Femurkopfes an. Daher entspricht die Kraft, die auf diesen einwirkt, einem Vielfachen des Körpergewichts. Die Belastung des Hüftgelenks kann je nach Rasse das 3- bis 4fache des Körpergewichts betragen. Bei einem 30 kg schweren Hund wirkt auf den Femurkopf z.B. eine Kraft von ungefähr 90 kg, wenn nur eine Hintergliedmaße belastet ist (Prieur, 1980).
Bei Beschleunigung des Körpers werden die im Hüftgelenk auftretenden Kräfte zusätzlich vergrößert (Prieur, 1980). Dies lässt sich durch folgende Gleichung erklären:
F = (Masse x Weg) / Zeit²
Bei einem Hund von 30 kg Körpergewicht, der z.B. mit 2 m/s² beschleunigt, vergrößert sich die Belastung des Hüftgelenks auf 180 kg. Hierbei treten Kräfte auf, die einem Vielfachen des Körpergewichts des Hundes entsprechen (Prieur, 1980).
Auch Arnoczky und Torzilli (1981) kamen zu dem Ergebnis, dass das Hüftgelenk größeren Kräften als dem einfachen Körpergewicht ausgesetzt ist. Basierend auf dem Prinzip des Gleichgewichts der Kräfte im Hüftgelenk berechneten sie in einem vereinfachten zweidimensionalen geometrischen Modell eine Kraft in Höhe des 1,5 fachen Körpergewichts, die während der dreibeinigen Standphase auf das belastete Hüftgelenk einwirkt. Die Hüftgelenkskraft wird darüber hinaus vermehrt durch verkleinerte Hebelarmlängen bei einem vergrößerten Halsschaftwinkel oder durch eine zusätzliche Abduktion der Gliedmaße. Grundlagen für das Modell waren anatomische Daten von Messungen aus einer Röntgenaufnahme eines Beckens und Femurs, die in Hebelarme und Momente umgerechnet wurden (Abb. 2.10 und Abb. 2.11).Das Modell ist beschränkt auf eine zweidimensionale Analyse der Kräfte in der Transversalebene, in der Abund Adduktionskräfte während der dreibeinigen Standphase des Ganges wirken.
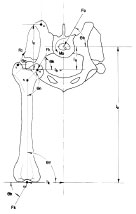
Abb. 2.10: Schemazeichnung auf Basis einer Röntgenaufnahme, aus welcher Abstände
und Winkel gemessen wurden (Abb. nach Arnoczky und Torzilli, 1981).
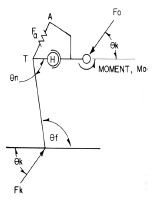
Abb. 2.11: Vereinfachtes Schema des Beckens und Femurs zur Darstellung der Kräfte,
die am Hüftgelenk wirken; A Ilium, Fa Abduktoren, H Femurkopf, T Trochanter, θn Halsschaftwinkel,
θf Adduktion des Femurs, Fk Bodenreaktionskraft am Knie (Abb. nach Arnoczky und Torzilli, 1981).
Dieses Modell wurde von Weigel und Wasserman (1992) weiterentwickelt, indem der Zusammenhang von Bewegung, Beschleunigung, Körpergewicht und Muskelzug auf die Größe der horizontalen und vertikalen Hüftgelenkskräfte demonstriert wird. Sie zeigten, dass sich die Belastung des Hüftgelenks durch eine lineare Beschleunigung und Winkelbeschleunigung vergrößert.
In einer kürzlich veröffentlichten Studie (Shahar und Banks-Sills, 2002) wurden die Hüftgelenkskräfte in einem dreidimensionalen mathematischen Modell der Hintergliedmaße des Hundes über Vereinfachungskriterien näherungsweise berechnet. Diese Berechnungen basierten auf Daten, die in einer früheren Untersuchung ermittelt wurden (Shahar und Milgram, 2001). Dies waren Muskellänge, physiologische Querschnitte, Insertions- und Ansatzstellen der Muskeln, Hebelarme und Gelenkwinkel. Die Kraft, die auf das Acetabulum einwirkt, wird hier mit Werten zwischen dem 0,73- und 1,04fachen Körpergewicht in der mittleren dreibeinigen Standphase des langsamen Ganges angegeben.
In einer Messung der Kräfte im Hüftgelenk mittels instrumentierter Prothesen in Kombination mit kinematischen Untersuchungen, wurden die Größe und Richtung der Kräfte auf das Hüftgelenk direkt in vivo ermittelt (Page et al., 1993; Bergmann et al., 1984).
Page et al. (1993) maßen für die Resultierende in der mittleren Standbeinphase im langsamen Schritt bei 1ms-1 einen Wert in Höhe des 1,65fachen Körpergewichts. Bergmann et al. (1984) ermittelten mit derselben Methode allerdings geringere Werte entsprechend dem 0,5- bis 0,8fachen Körpergewicht. Dies ist darauf zurückzuführen, dass der Einsatz der Prothesen einen erheblichen Eingriff darstellt, von dem sich die Tiere erholen müssen. Bei Page hat nur ein Hund von vieren die Gliedmaße postoperativ annähernd stark wie die gesunde Gliedmaße belastet. Bei Bergmann belastete kein Hund die Gliedmaße vollständig (gemessen mit Bodenkraftmessplatten).
2.2.2.2 Richtung der resultierenden Kraft R
Angaben zur Richtung des Kraftvektors der Resultierenden R in der mittleren
Standbeinphase des langsamen Schritts finden sich bei den bereits oben genannten
Arbeiten von Bergmann et al. (1984), Page et al. (1993) und Shahar
und Banks-Sills (2002). Dabei stimmen trotz unterschiedlicher Methoden (instrumentierte
Endoprothesen und dreidimensionales mathematisches Modell)
die ermittelten Werte gut überein. Der Nettokraftvektor der Resultierenden R
verläuft nach ventral, kaudal und lateral (Abb. 2.12 und Abb. 2.13). Er bildet
einen Winkel von 30° nach ventral in Relation zur Femurhals-(z)-Achse (Kegelwinkel
Φ) und 20° nach kaudal in Relation zur x-y-Ebene (Polarwinkel θ) (Page
et al., 1993). Ähnliche Winkel wurden bei Bergmann et al. (1984) und Shahar
und Banks-Sills (2002), allerdings unter Bezugnahme auf unterschiedliche Koordinatensysteme,
beschrieben.

Abb. 2.12: Richtung der Resultierenden (F), dargestellt an einem rechten Femurkopf
(Abb. nach Page et al., 1993); nähere Beschreibung siehe Text.

Abb. 2.13: Richtung von R auf den Kopf der Hüftendoprothese während eines Gangzyklus im
langsamen Schritt, R bildet einen Winkel von 20° zur Femurlängsachse (Abb. nach Bergmann et al., 1984).
2.2.2.3 Hüftgelenkwinkel
Die Winkelung im Hüftgelenk in der mittleren Standbeinphase des Ganges beim
Hund wurde in kinematischen Untersuchungen ermittelt. Das Femur befindet
sich in der mittleren Standbeinphase des Ganges in einem Flexionswinkel von
110° in Bezug zum Becken in der Sagittalebene, in einem Abduktionswinkel von
105° zum Beckenboden in der Transversalebene und einem Innenrotationswinkel
von 0° bezogen auf die Femurlängsachse (Page et al., 1993; vgl. Adrian et
al., 1966; Bergmann et al., 1984; Shahar und Banks-Sills, 2002).
2.2.3 Lastübertragung und Druckverteilung an der Gelenkfläche
In einem theoretischen Modell von Badoux und Hoogeveen (1976) wurde die
Belastung der Gelenkfläche durch eine geometrische Analyse des Acetabulum
und ganganalytische Untersuchungen ermittelt. Dabei vermuteten sie, dass eine
exzentrische Lasteinwirkung im Hüftgelenk eine entscheidende Rolle in der
Entstehung der Hüftgelenkdysplasie spielt.
Die geometrische Form des Acetabulum unterscheidet sich bei juvenilen und adulten Hunden. Bei juvenilen Hunden ist das Acetabulum oval geformt (Abb. 2.14 A), so dass bei Artikulation mit dem Femurkopf eine Inkongruenz vor allem im dorsalen Bereich vorhanden ist, die erst unter Belastung ausgeglichen wird. Die Form des Acetabulum des adulten Tiers ist rund und exakt kongruent (Abb. 2.14 B). Bei dysplastischen Acetabula fanden sie eine ähnlich ovale Form und schlossen daraus, dass dies die Form eines im Wachstum zurückgebliebenen juvenilen Acetabulum darstellt. Der schlechte Kontakt im dorsalen Bereich der Pfanne führt dabei langfristig aufgrund fehlender Stimulation des Knorpels zu einer Degeneration und Abflachung (Abb. 2.14 C).
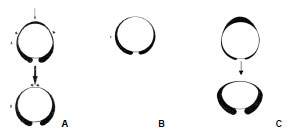
Abb. 2.14: Formen des Acetabulum, Transversalschnitt; A geringfügig inkongruentes Hüftgelenk
beim jugendlichen Hund, erst unter Belastung wird auch das Pfannendach zur Artikulationsfläche;
B Acetabulumform eines adulten Hundes; C Entwicklung der Hüftgelenkdysplasie;
aus der inkongruenten jugendlichen Acetabulumform entwickelt sich die dysplastische Form
durch die dauerhafte Nicht-Belastung des Pfannendachs; * = druckbelastete Stellen (Abb.
nach Badoux und Hoogeveen, 1976).
Prieur (1980) beschreibt die Verteilung des Belastungsdrucks auf der Gelenkfläche mit der allgemein gültigen physikalischen Formel, die Druck als Kraft pro Flächeneinheit definiert:
Druck = Kraft / Fläche
Aufgrund der Kongruenz der Gelenkknorpelflächen wird der Druck gleichmäßig über eine möglichst große Fläche der Gelenkflächen übertragen (Abb. 2.15). So beträgt beispielsweise der Druck auf einer Gelenkfläche von 1,5 cm² im Hüftgelenk eines 30 kg schweren Hundes 120 kg/cm² (Prieur, 1980).
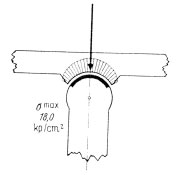
Abb. 2.15: Druckverteilung in einem gesunden Gelenk (Abb. nach Pauwels, 1973).
Wird die Kongruenz der Gelenkflächen verloren, entstehen Belastungsspitzen, da die Belastungsfläche verkleinert wird und somit der Druck steigt (Abb. 2.15). Die Folge sind eine Strapazierung des Gewebes und die Entstehung der Koxarthrose.
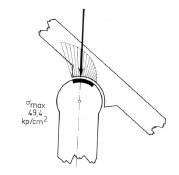
Abb. 2.16: Exzentrische Druckverteilung in einem subluxierten Gelenk (Abb. nach Pauwels, 1973).
Spannungsverteilung über Kugelgelenkflächen
Die Druckübertragung zwischen zwei Gelenkflächen ist nur durch Kraftvektoren möglich, die senkrecht zur Gelenkoberfläche stehen. Kummer (1968) zeigte, dass die druckübertragende Fläche in einem idealen Kugelgelenk nicht identisch ist mit der Kontaktfläche. Bei seiner Belastung ist selbst bei zentrischer Einwirkung des Kraftvektors die Spannungsverteilung im Gelenkknorpel nicht gleichmäßig (Kummer, 1968), sondern sie nimmt zum Durchstoßpunkt der Wirkungslinie der Kraft zu und nach den Rändern hin ab (vgl. Molzberger, 1973).
„Die Beanspruchung des Gelenks ist durch die Größe der von einer Gelenkfläche auf die andere übertragenden Normalkräfte charakterisiert. Diese Flächenkräfte rufen im beanspruchten Material Deformationswiderstände hervor: die Spannungen“ (Kummer et al., 1987).
Die Basis von Kummers theoretischem Modell ist ein ideal kongruentes Kugelgelenk aus nicht deformierbaren Material. Der Gelenkkopf wird von einer halbkugeligen Pfanne umschlossen. Die Spannungsverteilung über die Gelenkoberfläche ist abhängig von der Richtung der Gelenkresultierenden und ihrer Lage innerhalb der Kontaktfläche. Das Modell teilt die Resultierende R in viele parallele Kraftvektoren auf. Trifft die Resultierende R am Pol auf, so wird die gesamte Halbkugelfläche belastet und die Spannungen symmetrisch verteilt. An der Kontaktfläche können nur Kräfte übertragen werden, die senkrecht zur gewölbten Gelenkoberfläche stehen (Abb. 2.17).
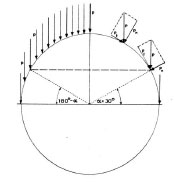
Abb. 2.17: Übertragung von Kräften über Kugelgelenkflächen; es werden nur Kräfte übertragen,
die senkrecht zur Oberfläche auftreffen; die Resultierende R kann in gleichgroße parallele
Teilkräfte p zerlegt werden, pn ist die senkrechte Komponente von p, pt ist die zur Gelenkfläche
parallel verlaufende Komponente (Abb. nach Kummer, 1968).
Trifft die Resultierende R außerhalb des Gelenkpols auf, liegt sie nicht mehr zentral und die Teilkräfte sind ungleich verteilt. Mit zunehmender exzentrischer Lage von R steigen die Spannungen gegen den Pfannenrand, die tatsächlich tragende Gelenkfläche nimmt stetig ab, da der Anteil der Teilkräfte geringer wird, die senkrecht zur Gelenkoberfläche stehen (Kummer et al., 1987).
2.2.4 Torsion des Os femoris
Der Grad der Torsion des Femurhalses nach kranial wird mit dem sog. Antetorsionswinkel
(ATW) angegeben (Abb. 2.18). Er wird zwischen der Femurkondylenebene
und der Achse des Femurhalses in der Transversalebene gemessenen
(Schawalder und Sterchi, 1981a).

Abb. 2.18: Antetorsionswinkel am rechten Os femoris.
Bei der Messung der Femurtorsion anhand von Femurpräparaten wurden durchschnittliche Werte zwischen 5,4° (Dueland, 1980) und 10° (Riser, 1973a; Riser et al., 1985) ermittelt. Mahringer (1991) maß an 105 mazerierten Femora mit dem Riedschen Messbrett, Ansteckgoniometer und Tasterzirkel einen Antetorsionswinkel von durchschnittlich 33° ±8,66°. Dabei ermittelte er Minimalwerte von 0° und einen oberen Grenzwert von 45°.
Bei der Messung der Femurtorsion am Röntgenbild bewegt sich der ATW zwischen Werten von 12° bis 40° mit mittleren Werten von 27° (Nunamaker et al., 1973). Mit der indirekten Messung anhand einer biplanaren Röntgenmethode wurden Winkel zwischen 18° bis 47° (Montavon, 1985) bestimmt mit Mittelwerten von 31° bis 33° (Bardet, 1983; Montavon, 1985; Montavon, 1992; Schawalder und Sterchi, 1981a; Schawalder und Sterchi, 1981b; Sterchi, 1980). Als pathologisch werden Werte unter 18° (26°) und über 42° (48°) beim DSH (Berner Sennenhund) angegeben. Normalwerte des ATW liegen zwischen 24- 36° (Schawalder und Sterchi, 1981a).
Mit einer neuen, computertomographischen Methode, die es ermöglicht, die Femurtorsion lagerungsunabhängig anhand von CT-Schnittbildern rechnerisch zu ermitteln, wurden Antetorsionswinkel zwischen durchschnittlich 33,8° (19- 50°) für große Rassen und 33,2° (17-49°) für kleine Rassen gemessen (Löer, 1999).
Der Vorteil dieser Methode besteht in der Eliminierung von lagerungsbedingten Messfehlern, was besonders für die Praxis von Bedeutung ist. Es werden Schichtaufnahmen durch die Knochenenden angefertigt und der ATW anhand genau festgelegter anatomischer Punkte im dreidimensionalen Koordinatensystem mit einem dafür entwickelten Computerprogramm berechnet. Einzige Voraussetzung beim indirekten computertomographischen Verfahren ist die parallele Lagerung der Schaftachse zur Längsachse des Untersuchungstisches. Der Grad der Eindrehung oder Streckung der Gliedmaße bleibt ohne Bedeutung, da dies rechnerisch durch Bestimmung der Schaftachse aus 2 anatomischen Fixpunkten (Halsbasismittelpunkt und distaler Schaftschnitt) korrigiert werden kann. Für die Berechnung des ATW benötigt das Computerprogramm 3 Bezugsachsen im Raum. Diese sind die Schaftachse, die Femurhalsachse und die Kondylenachse, die sich jeweils aus der Verbindung zweier Fixpunkte ergeben. Daher ist die Ermittlung von 5 anatomischen Fixpunkten notwendig. Diesen anatomischen Punkten kann der Computertomograph jeweils eine x- und y- Koordinate zuordnen. Die z-Koordinate ergibt sich aus der Tischposition.
Die Abhängigkeit des ATW von Alter, Rasse oder Geschlecht wird unterschiedlich beschrieben. Detaillierte Ausführungen dazu finden sich an anderer Stelle (Bardet, 1983; Hauptman und Butler, 1980; Löer, 1999; Mahringer, 1991; Montavon, 1992; Riser, 1973a; Schawalder und Sterchi, 1981a; Sterchi, 1980).
Biomechanische Überlegungen zur Torsion des Os femoris
Bei einem vergrößerten Antetorsionswinkel und Coxa valga ist der Hebelarm zwischen dem Zentrum des Femurkopfes und dem Trochanter major verkürzt. Daher wird der Druck, der auf den Femurkopf im Acetabulum wirkt größer (Arnoczky und Torzilli, 1981; Prieur, 1980) und die Entstehung von degenerativen Hüftgelenkerkrankungen begünstigt.
Ein vergrößerter ATW wurde von Montavon (1985) und Nunamaker (1974) mit der Entstehung von degenerativen Hüftgelenkserkrankungen in Verbindung gebracht, an anderer Stelle jedoch nicht (Schawalder et al., 1996). Der ursächliche Zusammenhang zwischen einem vergrößerten ATW und der Entwicklung der Hüftgelenkdysplasie (HD) wird ebenfalls kontrovers beurteilt. Während einige Autoren einen solchen Zusammenhang finden (Dueland, 1980), sehen andere keinen direkten Zusammenhang zwischen vergrößertem ATW und der HD (Hauptman et al., 1985; Riser und Shirer, 1966; Schawalder et al., 1997).
2.3 Morphologische und biomechanische Parameter
2.3.1 Physiologische Inkongruenz von Gelenken
Die Hauptverlaufsrichtung der Kollagenfasern, die Verteilung der Knochendichte
und die Verteilung der Druckmaxima auf Gelenkflächen zeigten, dass der
konkave Anteil von Gelenken mit einer tiefen Pfanne nicht nur auf Druck, sondern
maßgeblich auch auf Zug beansprucht wird. Dies spricht für ein Aufbiegen
der konkaven Gelenkpfanne unter Belastung.
Eckstein et al. (1995a, 1997b) etablierten in der Humanmedizin den Begriff der „konkaven Inkongruenz“ von Gelenken, der bedeutet, dass die Gelenkpfanne in konkaven Gelenkanteilen tiefer als nötig gebaut ist, um den konvexen Gelenkpartner aufzunehmen. Beim menschlichen Hüftgelenk ist das Acetabulum tiefer gebaut als es nötig wäre, um den Hüftgelenkkopf aufzunehmen (Bullough et al., 1968; Eckstein et al., 1997c; Tillmann, 1971; Tillmann, 1978a). Der Aufbau des Hüftgelenks ist vergleichbar mit einer Kugel, die in einen gotischen Bogen gedrückt wird (Bullough et al., 1968).
Die resultierende Hüftgelenkskraft wird initial über kleine periphere Kontaktflächen übertragen. Aber erst bei größeren Belastungen wird die Hüftgelenkpfanne aufgedehnt und der Hüftgelenkkopf vollends in die Pfanne gedrückt. Die druckübertragenden Flächen vergrößern sich in Richtung auf die Gelenkmitte unter vermehrter Aufspreizung des konkaven Acetabulum. Der Druck trifft somit nicht unmittelbar auf eine plane Artikulationsfläche auf, sondern wird im Gelenk gleichmäßig und in tiefere Schichten des Hüftknochens verteilt. Punktuelle Druckspitzen, wie sie zentral in kongruenten Gelenken auftreten, werden vermieden (Abb. 2.19).
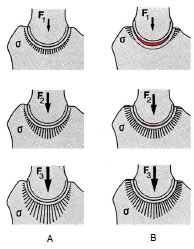
Abb. 2.19: Belastungsschema für das kongruente Gelenk (A) und das physiologisch inkongruente Gelenk
(B) unter geringer Belastung F1, und steigender Belastung F2, F3; die Verteilung des Drucks im physiologisch
inkongruenten Gelenk ist gleichmäßiger und ohne lokale Druckspitzen im Gegensatz zum kongruenten
Gelenk (Abb. nach Eckstein et al., 1993).
Von biomechanischer Sicht aus, ist dies eine sinnvolle Einrichtung, die garantiert, dass das Hüftgelenk ein Leben lang den enormen Belastungen standhält. Dabei werden vor allem auch die Randbereiche in die Belastung miteinbezogen. Dies ist nicht der Fall in einem kongruenten Kugelgelenk (Abb. 2.19 A), da sich hier der Druck vor allem zentral ausbreitet (Eckstein et al., 1994b). Ein geringgradig inkongruentes Gelenk ist also entgegen der herkömmlichen Auffassung nicht automatisch ein pathologisch verändertes Gelenk.
Die auf Zugbelastung ausgerichtete Struktur des Lig. transversum des Menschen bestätigt, dass Vorder- und Hinterhorn des Acetabulum unter der Belastung auseinandergedehnt werden, wenn der Femurkopf ins Acetabulum gepresst wird und somit die Inc. acetabuli aufdehnt. Das Lig. transversum spielt eine wichtige Rolle in der Aufrechterhaltung der natürlichen Inkongruenz (Löhe et al., 1996).
Das Phänomen der physiologischen Inkongruenz ist bei menschlichen Gelenken vielfach vertreten. Es wurde u.a. am menschlichen Hüftgelenk beobachtet (Afoke et al., 1980; Afoke et al., 1987; Bullough et al., 1973; Bullough et al., 1968; Eckstein et al., 1997a; Eisenhart-Rothe et al., 1997; Greenwald und O - Connor, 1971; Greenwald und Haynes, 1972; Müller-Gerbl et al., 1989; Müller- Gerbl et al., 1990; Müller-Gerbl et al., 1993c).
Auch beim Hund konnte bereits eine physiologische Inkongruenz für das Ellbogengelenk nachgewiesen werden (Dickomeit, 2002).
2.3.2 Spaltlinien
2.3.2.1 Knorpelspaltlinien
Mittels der Spaltlinienmethode kann die Ausrichtung der Kollagenfaserbündel in
der Tangentialfaserschicht des Gelenkknorpels makroskopisch sichtbar gemacht
werden (Tillmann, 1978b). Letztere sind Ausdruck eines größeren Widerstands
gegenüber einer Biegebeanspruchung in einer bestimmten Richtung.
Das Spaltlinienmuster auf einer Gelenkfläche ermöglicht eine Aussage über die
Spannungsverteilung und die Beanspruchung der jeweiligen Bereiche der Gelenkfläche.
Der Verlauf der Spaltlinien ist für jede Gelenkfläche weitgehend konstant.
Die Spaltlinienmethode wurde am Gelenkknorpel erstmals von Hultkrantz (1898) angewandt. Schon 1898 hat er den Aufbau des Gelenkknorpels mit der mechanischen Beanspruchung in Verbindung gebracht. Er stellte in seiner Studie fest, dass die Reibung an den Gelenkenden zweier Knochen und der Druck, den sie aufeinander ausüben, gewisse mechanische Druck- und Zugbelastungen hervorrufen, gegen die der Knorpel eine Widerstandsfähigkeit aufweisen muss. Diese ist nicht nach allen Seiten gleich groß, sondern in der Richtung der stärkeren Beanspruchung zeigt der Knorpel auch eine größere Festigkeit. Die Richtung der größten Zugfestigkeit eines Gewebes lässt sich mittels der Darstellung der Spaltrichtungen feststellen. Ein Einstich in ein Gewebe mit einer runden Nadel hinterlässt selten ein kreisrundes Loch, sondern eine feine gerade Spalte. Das Gewebe trennt sich leichter in der Richtung, die am wenigsten widerstandsfähig gegen Zug ist. Es entsteht ein Riss, der senkrecht dazu verläuft und der Vorzugsrichtung der Kollagenfasern entspricht. Färbt man diese Spalten mit Tinte, Tusche oder Farbe, so ergibt sich ein für dieses Gewebe typisches Muster aus feinen Linien, die parallel gerade, in Wirbeln oder divergierend verlaufen. Diese stimmen in der Richtung mit der mikroskopischen Feinfaserstruktur des Gewebes überein. Das entstehende Muster zeigt eine überraschende Konstanz und nur geringe individuelle oder altersbedingte Abweichungen am Knorpel.
Aus theoretischen Überlegungen heraus nahm Hultkrantz eine Zugspannung durch die Resultierende aus Reibung und Druck im Knorpel an. Die Ausrichtung der Kollagenfasern verstand er als Ausdruck der funktionellen Anpassung des Gelenkknorpels an seine mechanische Beanspruchung.
Benninghoff (1925b, 1925c) untersuchte die Verlaufsmuster der Spaltlinien im hyalinen Knorpel. Er postulierte, dass durch die Spaltlinien Dehnungsspannungen angegeben werden, die sich auf die Reibungsdeformation des Knorpels unter Belastung beziehen. Durch die zirkuläre Ausrichtung der Spaltlinien werden Druckpunkte auf der Knorpeloberfläche identifiziert. Es lassen sich ebenso faserig erweichte Bereiche finden, gerade in Knorpeln älterer Individuen, von welchen die Spaltlinien radiär auseinanderstreben. An diesen Stellen verhalten sich die Spaltlinien neutral in Form von runden oder sternförmigen Einstichen.
Pauwels (1959) zeigte durch einen spannungsoptischen Modellversuch am menschlichen Schulterpfannenknorpel, dass die Ausrichtung der Kollagenfaserbündel in der Tangentialfaserschicht des Gelenkknorpels ein „verkörpertes Spannungsfeld“ darstellt. Die kollagenen Fasern sind so angeordnet, dass sie bei der unter Belastung auftretenden Dehnung des Knorpelmaterials optimal Widerstand leisten können (Molzberger, 1973). Demnach wird der Gelenkknorpel nicht nur auf Druck, sondern auch auf Dehnung beansprucht. Der Vergleich von Spaltlinienmustern und spannungsoptischem Modellversuch zeigte, dass sich für die gefundenen Spaltlinienmuster die zugehörigen Spannungstrajektoren experimentell erzeugen lassen (Molzberger, 1973).
Die Gelenkfläche wird charakterisiert durch die Lage attraktiver singulärer Punkte und repulsiver singulärer Punkte (Pauwels, 1959). Um einen attraktiven singulären Punkt laufen die Spaltlinien konzentrisch herum, wobei sie meist bogenförmig angeordnet sind. Attraktive singuläre Punkte entstehen an Orten höheren Drucks. An repulsiven singulären Punkten streben die Spaltlinien divergierend in 3 Richtungen auseinander. Repulsive singuläre Punkte entstehen an Orten niedrigerer Druckbelastung. Attraktive singuläre Punkte sind im spannungsoptischen Modellversuch stets mit repulsiven singulären Punkten kombiniert (Konermann, 1971; Tillmann, 1973).
Des Weiteren charakteristisch sind faserknorpelige Erweichungen (Pauwels, 1959). Dies sind Bereiche, in denen sich keine Spaltlinien erzeugen lassen. Sie fallen in der Lokalisation mit der Lage der singulären attraktiven und repulsiven Punkte zusammen. Erklärt werden kann dieses Phänomen dadurch, dass sowohl an Orten unphysiologisch hoher Druckbelastung, als auch an Orten, an welchen der Erhaltungsreiz des Knorpelgewebes unterschritten wird, der Knorpel sich verändert (Molzberger, 1973; Pauwels, 1959). Die Erweichung oder das Verschwinden von Gelenkknorpel an repulsiven singulären Punkten stimmt mit Pauwels Theorie von der kausalen Histogenese überein. Knorpelverdünnungen oder Knorpelerweichungen treten an Orten auf, die keiner oder geringer Belastung ausgesetzt waren und somit einen unzureichenden Erhaltungsreiz erfahren haben (Molzberger, 1973). Knorpelveränderungen in der Umgebung von attraktiven singulären Punkten resultieren aus unphysiologisch hohem Druck (Tillmann, 1978a).
Diese Ergebnisse konnten an weiteren Gelenkflächen der Gliedmaßen von Menschen bestätigt werden durch Untersuchungen am Talo-Navikulargelenk (Konermann, 1971), am Hüftgelenk (Kummer, 1968; Meachim et al., 1974; Molzberger, 1973; Tillmann, 1973; Tillmann, 1978a) und Ellbogengelenk (Tillmann, 1978a).
2.3.2.2 Subchondrale Spaltlinien
Die subchondrale Knochenplatte ist die Knochenlamelle unterhalb der Gelenkknorpelfläche,
die fest verschmolzen ist mit der tiefsten kalzifizierten Knorpelzone.
Ihre Dicke liegt zwischen 120-1400 μm (Milz und Putz, 1994).
Ebenso wie die Spaltlinien des Gelenkknorpels, zeigen die Spaltlinien am entmineralisierten Knochen die Richtung an, in der der Zugwiderstand am größten ist (Benninghoff, 1925a). An der knöchernen Gelenkfläche selbst waren keine Spaltlinien zu erzeugen, sondern nur runde Löcher. Dies führte Benninghoff darauf zurück, dass von der verkalkten Knorpelzone, der tiefsten Zone des Gelenkknorpels, die Kollagenfasern senkrecht in den Knochen einstrahlen.
Schön et al. (1998) formulierten die Hypothese, dass sich vorhandene Zugspannungen im subchondralen Knochen von Gelenkflächen in Form einer Ausrichtung der Kollagenfasern in einer Hauptverlaufsrichtung nachweisen lassen. Da sich Binde- und Stützgewebe an seine mechanische Beanspruchung anpasst (Kummer, 1962; Pauwels, 1965; Pauwels, 1980; Wolff, 1892), kann man von der Struktur eines Gewebes auf seine längerfristige Belastung zurückschließen. Somit verkörpert die Kollagenfaserarchitektur eine funktionelle Anpassung des subchondralen Knochens an seine mechanische Zugbeanspruchung. Computersimulationen (Eckstein et al., 1997c) legten die Vermutung nahe, dass Zugspannungen im Gelenk durch eine Biegebeanspruchung bei der exzentrischen oder bizentrischen Druckübertragung in inkongruenten Gelenken die Druckbelastung um ein Vielfaches übersteigen (Schön et al., 1998). In einer Untersuchung der Spaltlinienmuster an der subchondralen Knochenplatte von menschlichen Ellbogen- und Kniegelenken konnten sie diese Hypothese bestätigen.
Vogt et al. (1999b) untersuchten die subchondralen Spaltlinien an menschlichen Hüft- und Schultergelenkspräparaten und konnten ebenso eine Zugspannung für diese beiden Gelenke indirekt über das Spaltlinienmuster nachweisen. Durch Kombination mit einer Untersuchung der druckübertragenden Flächen mittels drucksensitiven Films (Vogt et al., 1999b) konnte gezeigt werden, dass die Zugspannungen durch eine bizentrische Druckverteilung (ventro-superior und dorso-superior) und somit durch eine Aufspreizung während der Belastung im Gelenk entstehen (Vogt et al., 1999a; Vogt et al., 1999b). Die Ausrichtung der Spaltlinien an der subchondralen Knochenplatte zeigen, dass der subchondrale Knochen von konkaven Gelenkflächen weniger durch Druckbelastung, sondern maßgeblich von Dehnungsspannungen geformt wird (Vogt et al., 1999a; Vogt et al., 1999b). Durch überwiegende Druckübertragung über die peripheren Anteile der Facies lunata (Afoke et al., 1987; Eisenhart-Rothe et al., 1997; Eisenhart-Rothe et al., 1999) wird das Acetabulum während der Belastung aufgebogen. An der subchondralen Knochenplatte von konvexen Gelenkpartnern wird keine Biegebeanspruchung erwartet. Daher ließen sich hier auch keine Spaltlinien erzeugen (Vogt et al., 1999a).
2.3.3 Dichtebestimmung der subchondralen Knochenplatte
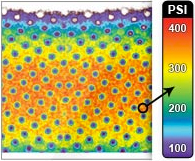
Müller-Gerbl et al. (1989, 1990; 1992) haben die Methode der Computertomographischen
Osteoabsorptiometrie (CT-OAM) entwickelt, mit der die Verteilung
der subchondralen Knochendichte einer Gelenkfläche am lebenden Patienten
ermittelt werden kann. Die Knochendichte gibt indirekt Aufschluss über
die individuelle Beanspruchungssituation im Gelenk. Aus aufbereiteten CTDatensätzen
wird die Dichte des subchondralen Knochens 1 mm unterhalb der
Gelenkfläche bestimmt und mit Falschfarben belegt. Diese werden auf die rekonstruierte
Gelenkfläche projiziert, wodurch Dichtekarten für die individuellen
Gelenkflächen erhalten werden.
Am menschlichen Hüftgelenk durchgeführte Untersuchungen der Knochendichte mittels Röntgendensiometrie (Oberländer, 1973) und CT-Osteoabsorptiometrie (Eisenhart-Rothe et al., 1997; Müller-Gerbl et al., 1993c) führten zu vergleichbaren Ergebnissen.
1973 untersuchte Oberländer (1973) als einer der ersten die Knochendichte im Acetabulum des menschlichen Hüftgelenks. Dabei fand er die größte Dichte am Rand der Facies lunata, zum inneren Rand hin nahm die Dichte ab. Bei Gelenkflächen von jugendlichen Menschen wurde eine geringere Knochendichte im Pfannendach festgestellt. Am Boden der Fossa acetabuli lag ein Dichteminimum, zur Inc. acetabuli stiegen die Dichtewerte wieder an. Oberländer (1973) erklärte die vermehrte Knochendichte an den Randbereichen durch eine exzentrische Lage der Gelenkresultierenden oder durch eine funktionell bedingte Knorpelquellung (Eckholm und Ingelmark, 1952; Ingelmark und Eckholm, 1948) und dadurch entstehende Inkongruenz. Die geringere Dichte im Pfannendach erklärte er durch die im jugendlichen Gelenk bestehenden Inkongruenz (Goodfellow und Bullough, 1968; Greenwald und O'Connor, 1971; Greenwald und Haynes, 1972).
In späteren Untersuchungen mittels der CT-OAM (Eisenhart-Rothe et al., 1997; Müller-Gerbl et al., 1993c) wurde regelmäßig eine höhere Knochendichte am äußeren Gelenkrand gefunden, die zum Gelenkzentrum hin abnimmt. Es wurde ebenso ein bizentrisches Verteilungsmuster der Knochendichte ermittelt. Die Maxima liegen zumindest bei jüngeren Menschen im Vorder- und Hinterhorn, während Dichteminima im Pfannendach zu finden sind. Bei älteren Menschen wechselt das Mineralisierungsmuster von der bizentrischen zu einer monozentrischen Verteilung. Diese geometrische Veränderung wurde mit dem Beginn der Osteoarthrose in Zusammenhang gebracht (Müller-Gerbl und Putz, 1993).
Eisenhart-Rothe et al. (1997) fanden monozentrische, bi- und trizentrische Verteilungsmuster der Knochendichte. Maxima wurden im Pfannendach, in Vorderund Hinterhorn oder an allen drei Orten lokalisiert. Eisenhart-Rothe et al. (1997) konnten keine signifikante Beziehung zwischen Altersverteilung und Knochendichteverteilung ermitteln.
Da das Acetabulum tiefer ist als erforderlich für die Artikulation mit dem Femurkopf, kommt es während der Belastung des Hüftgelenks zu einer Aufweitung des Acetabulum. Dadurch erfährt auch die subchondrale Knochenplatte eine Dehnungsbeanspruchung, die sich an den Orten höherer Knochendichte manifestiert. Durch das Aufspreizen entstehende Zugspannungen können auch erklären, warum in inkongruenten Gelenken mit bizentrischer Druckübertragung ein subchondrales Dichtemaximum im Pfannendach gefunden wird, obwohl hier keine Druckspannung zu messen war (Eisenhart-Rothe et al., 1997).
Dieses Prinzip konnte auch für andere menschliche Gelenke der Gliedmaßen, die eine tiefere Pfanne besitzen, gezeigt werden. Dazu gehören das Ellbogengelenk (Eckstein et al., 1993a; Eckstein et al., 1993b; Eckstein et al., 1994a; Eckstein et al., 1995c), das Kniegelenk (Eckstein et al., 1992; Müller-Gerbl et al., 1993b) und das Schultergelenk (Müller-Gerbl et al., 1988).
Untersuchungen an Schulter-, Ellbogen- und Hüftgelenken von Hunden (Dickomeit, 2002; Maierl et al., 1998a; Maierl et al., 1998b; Maierl und Böttcher, 1999; Maierl et al., 1999; Maierl et al., 2000a; Maierl et al., 2000b; Misof et al., 1999) und an Schulter- und Zehengelenken von Pferden (Böhmisch, 1998; Böttcher et al., 1999; Maierl et al., 2001) konnten Gleiches auch in Gelenken der genannten Spezies verwirklicht finden.
Weiterführend ist es möglich, aus Daten der Knochendichte auf die längerfristige Beanspruchung rückzuschließen. So konnte aus CT-Datensätzen von Femora die Richtung der Resultierenden im Hüftgelenk für physiologische Belastungen sowie für Coxa vara und Coxa valga mittels der Finiten Element Methode berechnet werden (Eckstein et al., 1997a).
Des Weiteren können mit der CT-OAM Therapieverläufe dokumentiert werden. Stampfer et al. (1999) untersuchten das subchondrale Mineralisierungsmuster bei humaner Hüftgelenkdysplasie und nach Umstellungsosteotomie. Das Acetabulum des gesunden Hüftgelenks weist sein größtes Dichtemaximum im Pfannendach auf. Weitere kleinere Maxima befinden sich in Vorder- und Hinterhorn. Beim dysplastischen Acetabulum ist das Maximum im Dach auf eine kleinere Fläche konzentriert, an Intensität stärker und nach anterio-superior verschoben. Nach Umstellungsosteotomie nimmt das Maximum an Intensität ab, die druckübertragende Fläche wird wieder größer und seine Lage bewegt sich in Richtung jener im gesunden Gelenk.
2.3.4 Druckhöhe, Druckverteilung und Kontaktflächen der Gelenkfläche
Untersuchungen an menschlichen Hüftgelenken (Eisenhart-Rothe et al., 1996;
Eisenhart-Rothe et al., 1997; Eisenhart-Rothe et al., 1999) haben gezeigt, dass
der Druck nicht gleichmäßig über die Gelenkfläche verteilt ist und die Verteilung
maßgeblich von der Geometrie des Gelenks, sprich der physiologischen Inkongruenz,
abhängt. Ein weiterer möglicher Grund für die inhomogene Verteilung
des Drucks ist die ungleiche knöcherne Unterstützung des Acetabulum (Dalstra
und Huiskes, 1995; Eisenhart-Rothe et al., 1999).
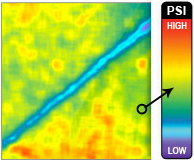
Verschiedene Studien bestimmten die Höhe und Verteilung des Drucks im menschlichen Hüftgelenk unter physiologischen Belastungen experimentell mittels FUJI-Druckmeßfolie für verschiedene Phasen des Ganges (Eisenhart- Rothe et al., 1999) oder die mittlere Standbeinphase des Ganges (Eisenhart- Rothe et al., 1996; Eisenhart-Rothe et al., 1997). Afoke et al. (1987) haben gezeigt, dass eine Messung der Druckverteilung im Hüftgelenk mit drucksensitiven Film eine geeignete Methode ist. Die Kontaktflächen wurden durch Polyätherabdruckmasse bestimmt (Eckstein et al., 1997d; Eisenhart-Rothe et al., 1997).
Die Ergebnisse verdeutlichten, dass der Gelenkdruck sehr inhomogen über die Facies lunata verteilt ist (Afoke et al., 1987; Brown und Shaw, 1983; Eisenhart- Rothe et al., 1996; Eisenhart-Rothe et al., 1997; Eisenhart-Rothe et al., 1999). Es wird jeweils nur ein Teil der Gelenkfläche für die Druckübertragung genutzt. Die druckübertragenden Flächen waren vor allem am äußeren Rand des Pfannendachs lokalisiert. Bei zunehmender Last weiteten sie sich zum Zentrum der Facies lunata in Richtung auf die Fossa acetabuli aus (Afoke et al., 1987; Eisenhart- Rothe et al., 1996; Eisenhart-Rothe et al., 1997; Eisenhart-Rothe et al., 1999).
Neben individuellen Unterschieden wurden Druckmaxima im ventralen und dorsalen Bereich gefunden, die sich bei zunehmender Belastung in Richtung Pfannendach ausdehnen, aber bis in hohe Belastungen von 200-300% des Körpergewichts deutlich getrennt erkennbar bleiben (Afoke et al., 1987; Eisenhart- Rothe et al., 1996; Eisenhart-Rothe et al., 1999).
In einigen Gelenken wurde ein Druckmaximum schon bei geringer Belastung im Pfannendach gemessen. Die druckübertragenden Flächen breiten sich hier bei steigender Belastung in Richtung auf das Vorder- und Hinterhorn aus (Eisenhart-Rothe et al., 1996; Eisenhart-Rothe et al., 1999).
Der Verteilungstyp, bei dem die Druckmaxima initial bizentrisch verteilt waren, wies insgesamt geringere maximale Druckhöhen auf (Eisenhart-Rothe et al., 1996).
Druckmaxima liegen zwischen 4-10 MPa, (Afoke et al., 1987; Eisenhart-Rothe et al., 1996; Eisenhart-Rothe et al., 1997; Eisenhart-Rothe et al., 1999), durchschnittlich bei 7,7 MPa ±1,7, in der mittleren Standbeinphase (Eisenhart-Rothe et al., 1999). Diese Werte fanden sich in guter Übereinstimmung mit Werten aus anderen Studien, die Kontaktdrücke mittels Knorpeldeformationsberechnungen (Day et al., 1975) oder Computersimulationen (Carter et al., 1987; Dalstra und Huiskes, 1995) kalkulierten.
Die mittels Abformmassen untersuchten Kontaktflächen zeigten ein ähnliches Verteilungsmuster wie die mit Fuji Film ermittelten druckübertragenden Flächen. Der Kontakt beginnt zuerst lateral am Pfannenrand bei geringeren Belastungen und wird dann mit steigendem Druck nach medial, zur Fossa acetabuli hin, vergrößert (Afoke et al., 1980; Afoke et al., 1987; Bullough et al., 1973; Eisenhart- Rothe et al., 1997; Goodfellow und Mitsou, 1977; Greenwald und O'Connor, 1971). Auch hier wurden wieder zwei verschiedene Verteilungstypen gefunden. In einigen Gelenken war die Belastung zuerst am äußeren Pfannendach lokalisiert und dehnte sich dann nach zentral und ins Vorder- und Hinterhorn aus (vgl. Brown und Shaw, 1983; Eckstein et al., 1997d; Eisenhart-Rothe et al., 1997). In anderen Gelenken waren bei geringen Belastungen die Kontaktflächen zuerst in Vorder- und Hinterhorn und erst bei höheren Belastungen im Pfannendach zu finden (Afoke et al., 1987; Day et al., 1975; Eckstein et al., 1997d; Eisenhart-Rothe et al., 1997). Die Kontaktflächen vergrößern ihren Anteil von 20% auf 98% der Facies lunata bei höheren Belastungen (Eckstein et al., 1997d).
Ähnliches wurde auch in anderen Gelenken beobachtet, so z.B. im Ellbogengelenk (Eckstein et al., 1993; Eckstein et al., 1994a; Eckstein et al., 1995a). Die Ergebnisse zeigten, dass die Größe der Kontaktflächen eine Funktion der steigenden Belastung darstellt.
Die Position und Größe der Kontaktflächen hängen von den Kräften ab, die auf das Gelenk einwirken, aber auch von der Geometrie der Gelenkflächen (Bullough et al., 1973; Greenwald und Haynes, 1972). Das bizentrische Verteilungsmuster der Kontaktflächen und der weite zentrale Gelenkspalt legten die Vermutung nahe, dass das gesunde Hüftgelenk eine natürliche Inkongruenz aufweist. Auch mit zunehmender Belastung bleibt die physiologische Inkongruenz über einen weiten Bereich physiologischer Belastungen erhalten (Afoke et al., 1980; Greenwald und Haynes, 1972).
Da das Acetabulum tiefer gebaut ist, als es einer exakten Passform mit dem Femurkopf entspricht, nimmt die druckübertragende Fläche bei anwachsender Last zu. Dabei werden die Druckmaxima nach zentral verschoben (Eisenhart- Rothe et al., 1999). Dies erklärt auch den nichtlinearen Zusammenhang zwischen Lasteinleitung und Druckmaximum. Während sich in den Phasen des Ganges die Kraft ca. auf das 3,5fache erhöht, steigt der Gelenkdruck nur auf das 1,3fache des Körpergewichts. Das druckverteilende Bauprinzip bewirkt, dass trotz relativ konstanter Lage der Gelenkresultierenden alle Gelenkflächenanteile einer intermittierenden Beanspruchung unterliegen. So werden Druckspitzen vermieden, die zu einer Überbelastung des Gelenkknorpels führen könnten. Durch die Verschiebung der druckübertragenden Fläche über die gesamte Gelenkfläche während des Gehens erfährt der Knorpel eine optimale Schmierung und Ernährung. Die physiologische Inkongruenz gewährleistet, dass trotz starker Schwankungen der auftretenden Kräfte während der Bewegung die Druckmaxima im Hüftgelenk relativ konstant bleiben und einen Höchstwert von 10 MPa nicht überschreiten (Eisenhart-Rothe et al., 1999).
Es wurde ein direkter räumlicher Zusammenhang zwischen Lokalisation der maximalen Drücke im antero-superioren Bereich und der häufigsten Lokalisation von degenerativ progressivem Knorpelverlust bei Osteoarthrose hergestellt (Afoke et al., 1987).
3 Material und Methoden
In der vorliegenden Arbeit wird aus Gründen der exakteren Beschreibung die
Facies lunata in Anlehnung an die Humanmedizin (Eckstein et al., 1997d; Eisenhart-
Rothe et al., 1999; Oberländer, 1973) weiter unterteilt in Vorderhorn,
Hinterhorn und Pfannendach.
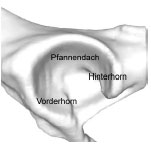
Abb. 3.20: Schematische Darstellung des Acetabulum eines Hundes: Definition der Gelenkflächenabschnitte.
3.1 Untersuchungsgut
Es wurden die Hüftgelenke von 164 Hunden präpariert und untersucht. Die Gelenke
stammten von aus medizinischen Gründen euthanasierten Tieren aus
dem Anatomischen Präparierkurs des Instituts für Tieranatomie I. Die Tiere
zeigten keine Anzeichen von lokalen oder allgemeinen Erkrankungen des Bewegungsapparates.
Makroskopisch sichtbare Knorpelschäden oder andere Anzeichen
degenerativer Gelenkveränderungen an Hüft- und Kniegelenk galten
als Ausschlusskriterium für die Auswahl zur weiteren Untersuchung. Es schieden
121 Hunde (siehe Anhang Tab. 8.1 und Tab. 8.2) aufgrund von Knorpelschäden
oder Deformationen des Gelenks für weitere Untersuchungen aus. 43
Hunde, d.h. insgesamt 86 Hüftgelenke (jeweils rechtes und linkes Hüftgelenk
eines Hundes) wurden in die Studie aufgenommen (Tab. 3.1).

Tab. 3.1: Hunde mit intaktem Gelenkknorpel
Da für die Hunde keine Altersangaben vorlagen, erfolgte eine Altersbestimmung anhand Schätzung des Zahnalters (Habermehl, 1961). Diese Form der Altersbestimmung stellt nur eine ungefähre Schätzung dar, daher beschränkt sich die Angabe des Alters der Hunde auf die Zuteilung zu Altersgruppen (Tab. 3.2).
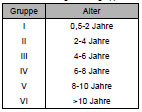
Tab. 3.2: Einteilung in Altersgruppen
Die Hüftgelenke stammten von überwiegend großwüchsigen Rassen mit einem mittleren Gewicht von 29 kg (Abb. 3.1). Das durchschnittliche Alter lag bei ca. 6 Jahren (Abb. 3.2). Die Geschlechterverteilung war mit 20 Hündinnen und 23 Rüden ausgewogenen.
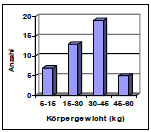
Abb. 3.1: Körpergewichtverteilung der Hunde mit intaktem Gelenkknorpel.
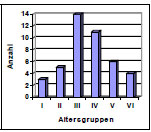
Abb. 3.2: Altersverteilung der Hunde mit intaktem Gelenkknorpel.
3.2 Vorbereitung und Präparation
Die Hüftgelenke wurden vorsichtig durch Abpräparieren der Muskulatur und
Weichteile unter Schonung der Gelenkknorpelschicht bis auf die Kapsel freigelegt.
Die Eröffnung des Hüftgelenks erfolgte entlang des Gelenkkapselansatzes am Femurhals. Nach Adspektion und Beurteilung der Gelenkkapsel, der Gelenkform, der Gelenkflächen sowie des Lig. capitits ossis femoris, wurde letzteres an seinem Ansatzpunkt an der Fovea capitis durchtrennt. Je nach weiterer Untersuchungsabsicht wurde entweder das Becken kranial zwischen den letzten Lendenwirbeln und Kreuzbein sowie kaudal zwischen Kreuzbein und ersten Schwanzwirbeln abgesetzt und als Ganzes entnommen oder nur die Hüftgelenksregion mit drei Sägeschnitten durch Os ilium, Os pubis und Os ischii aus dem Becken herausgelöst. Die ganzen Hüften wurden für die weiteren Untersuchungen in der Mitte der Symphysis pelvina und der Mitte der Wirbelkörper entlang der Medianen geteilt. Die Ossa femoris wurden im Kniegelenk abgesetzt. Die Hemipelves und dazugehörigen Femora wurden in mit Phosphatpuffer getränkten Tüchern eingewickelt und bis zur weiteren Verwendung in luftdicht verschlossenen Polyethylenbeuteln bei -18°C eingefroren. Am Tag vor der Untersuchung wurden sie bei Zimmertemperatur aufgetaut. Während der Untersuchung wurden alle Gelenkoberflächen mit in Phosphatpuffer (pH 7,4) getränkten Einmaltüchern feucht gehalten.
3.3 Anatomisch-makroskopische Untersuchung
Nach Disartikulation (Eröffnung der Kapsel und Durchtrennung des Lig. capitis
ossis femoris) wurde das Hüftgelenk einer genauen Adspektion unterzogen und
beurteilt.
Es wurden beurteilt:
− die Form des Gelenks (HD, Osteoarthrose, Osteophyten),
− der Kapselzustand (Verdickung, Verschwartung, Knorpeleinlagerungen),
− der Zustand des Gelenkknorpels (Feuchtigkeit, Farbe, Glätte, Erosionen),
− die Synovia (Anwesenheit, Viskosität, Farbe) und
− das Lig. capitis ossis femoris (Auffaserungen v. a. an seiner Ansatzstelle an der Fovea capitis ossis femoris).
Knorpelschäden und andere pathologische Veränderungen wurden in Grad und Lokalisation mittels Skizzen und Fotografien dokumentiert, um später eventuelle Rückschlüsse auf die mechanischen Ursachen von degenerativen Gelenkerkrankungen ziehen zu können (Tab. 3.3 und Tab. 3.4). Bei den Knorpelläsionen wurde zwischen fünf makroskopisch sichtbaren Graden der Schädigung differenziert:
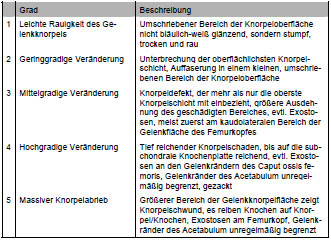
Tab. 3.3: Einteilung der Knorpelschäden in Grade
Die von der weiteren Untersuchung ausgeschlossenen dysplastischen Hüftgelenke wurden zur Dokumentation nach folgender Tabelle beurteilt:

Tab. 3.4: Einteilung der dysplastischen Veränderungen
3.4 Spaltlinien
3.4.1 Spaltlinien der subchondralen Knochenplatte
Es wurden die subchondralen Knochenplatten von je 7 entkalkten Acetabula
und Capita ossis femoris von Hunden großer Rassen untersucht.
Die Gelenke stammten aus dem Anatomischen Präparierkurs. Es wurden vier linke und drei rechte Hüftgelenke ausgewählt. Angaben zu Rasse, Alter und Gewicht lagen nicht vor. Die Präparate wurden gelenksnah abgesetzt. Das Os femoris wurde distal des Trochanter major abgesetzt, das Acetabulum nach Durchtrennung von Os ilium, Os ischii und Os pubis entnommen.
Die disartikulierten Gelenke wurden zunächst von den Weichteilen befreit und in Natriumcarbonatlösung mazeriert (2-3 Tage bei 80 C°). Anschließend erfolgte die Entmineralisierung in 5%iger Salpetersäure, bis der Knochen weich genug war, um ohne Kraftanstrengung einstechen zu können (10-14 Tage). Alternativ dazu wurde an 2 Präparaten die Entkalkung in einem elektrolytischen Entkalkungsgerät (EG-33, Medax Nagel GmbH, Kiel) mit Ameisensäure durchgeführt. Diese Form der Entkalkung wird durch das angelegte elektrische Feld stark beschleunigt und ist daher schonender für das Präparat, da die Säure kürzer auf das Präparat einwirkt. Vor dem Beginn der Spaltlinienuntersuchung wurden die Präparate für ca. 10 Minuten in Natriumbiphosphatpuffer eingelegt.
Die Bestimmung der subchondralen Spaltlinienmuster am kaninen Hüftgelenk erfolgte nach der Spaltlinienmethode (modifiziert nach Benninghoff, 1925a; Hultkrantz, 1898). Dazu wird eine runde Metallnadel mit konischer, scharfer Spitze in Tinte getränkt und in regelmäßigen Abständen in einem Winkel von 90° zur Gelenkoberfläche in die subchondrale Knochenplatte eingestochen und dann zurückgezogen, ohne die entstehenden Spalten künstlich zu erweitern. Es bleiben meist keine kreisrunden Einstichlöcher zurück, sondern es bilden sich Spalten. Deren Ausrichtung wird durch den Verlauf der Kollagenfasern bestimmt, eine Beobachtung, die schon von Benninghoff (1925b) erstmals gemacht wurde. Es wird davon ausgegangen, dass sich die Tinte in den entstehenden Spalten längs entlang der Kollagenfaserbündel ausbreitet. Somit entsprechen die Spaltlinienmuster der Vorzugsrichtung der Kollagenfasern. Diese wurden anhand von digitaler Fotografie und schematischer Skizzenzeichnungen aus vier verschiedenen Perspektiven dokumentiert. Die stark gewölbten Gelenkflächen von Facies lunata und Caput ossis femoris machten es nahezu unmöglich, die Gelenkfläche ohne perspektivische Verzerrung in einem einzigen Bild zu erfassen.
Ziel dieser Methode ist es, die Vorzugsrichtung der Kollagenfasern im subchondralen Knochen sichtbar zu machen und daraus Rückschlüsse auf die Morphologie und Beanspruchung des Gelenks ziehen zu können.
3.4.2 Spaltlinien des Gelenkknorpels
Muskeln und Weichteile wurden von 20 Hundehüften entfernt, die Gelenkkapsel
freigelegt, das Gelenk eröffnet, die Gelenkknorpeloberfläche makroskopisch
beurteilt und ständig mit in Phosphatpuffer getränkten Einmaltüchern feucht
gehalten. An je 20 linken und rechten einwandfreien Gelenkknorpelflächen von
Acetabulum und Femurkopf wurde die Ausrichtung der Kollagenfasern der Tangentialfaserschicht
mittels der Spaltlinienmethode untersucht.
Dabei handelte es sich um Hüftgelenke von 7 Hündinnen und 13 Rüden mit einem Durchschnittsalter von 6,5 Jahren und einem Durchschnittsgewicht von 30 kg. Rasse, Geschlecht, Körpergewicht und Alter sind in nachstehender Tabelle aufgelistet (Tab. 3.5).
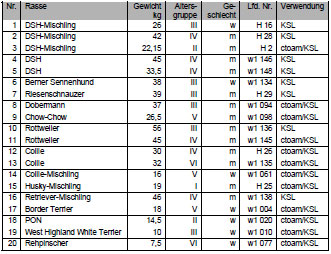
Tab. 3.5: Untersuchungsgut Knorpelspaltlinien
Die Bestimmung der Spaltlinienmuster am kaninen Hüftgelenk erfolgte nach der Spaltlinienmethode (modifiziert nach Benninghoff, 1925b, Konermann, 1971). Durch sie lässt sich die Hauptrichtung der Fasern in der oberflächlichsten Schicht des Gelenkknorpels, der Tangentialfaserschicht, makroskopisch darstellen. Es wird mit einer runden, konisch zugespitzten Stecknadel in regelmäßigen Abständen in einem Winkel von 90° zur Gelenkoberfläche in den Gelenkknorpel eingestochen. Dadurch bilden sich Spalten, die bei den untersuchten
Individuen einem charakteristischen Muster folgen. Diese typische Verlaufsrichtung der Spaltlinien wird durch die Anordnung der Kollagenfaserbündel bestimmt, zwischen welchen sich die Spalten bilden. Die entstandenen Spalten werden unmittelbar nach dem Einstich mit Tinte gefärbt. Dazu wird die gesamte Gelenkknorpelfläche mit Tinte eingerieben und der Überschuss anschließend mit Phosphatpuffer wieder ausgewaschen. Zurück bleiben die angefärbten Spalten. Die typischen Verlaufsmuster wurden unter der Lupe ausgewertet und in Form von schematisierten Skizzenzeichnungen und digitalen Fotografien dokumentiert. Dies erfolgte aus den vier gleichen Perspektiven wie bei der Untersuchung der subchondralen Spaltlinien. Die skizzierte Darstellung zeigt die Spaltlinien in einem größeren Abstand als im Original. Dabei wurde aus Gründen der Übersichtlichkeit nicht jede einzelne Spaltlinie übernommen, sondern das Hauptaugenmerk auf die Dokumentation des Gesamtverlaufs gerichtet.
3.5 CT-Osteoabsorptiometrie
Die subchondrale Knochendichte wurde mittels der computertomographischen
Osteoabsorptiometrie (CT-OAM) an 60 Hüftgelenken bestimmt. Dazu wurde die
Methode nach Müller-Gerbl et al. (1989, 1990; 1992) angewandt.
3.5.1 Untersuchungsgut
Untersucht wurden 60 Hüftgelenke von 30 Hunden (Tab. 3.6). Diese stellten
eine Auswahl einwandfreier Hüftgelenke aus 164 Präparaten aus dem Anatomischen
Präparierkurs dar. Der Schwerpunkt lag dabei auf großwüchsigen
Hunderassen. Das Körpergewicht der Hunde lag zwischen 7,5 kg und 53 kg
(Durchschnitt 25 kg) (Abb. 3.3). Das Alter betrug zwischen 0,5 und 12 Jahren
(Durchschnittsalter 6 Jahre) (Abb. 3.4). Von den 30 Hunden waren 14 weiblich
und 16 männlich.

Tab. 3.6: Hunde, die zur Bestimmung der subchondralen Knochendichte herangezogen wurden
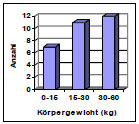
Abb. 3.3: Körpergewichtverteilung der Hunde, an deren Hüftgelenken die
subchondrale Knochendichte bestimmt wurde.
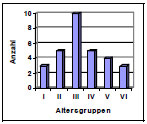
Abb. 3.4: Altersverteilung der Hunde, an deren Hüftgelenken die subchondrale Knochendichte bestimmt wurde.
3.5.2 Grundlagen
Bei der Computertomographie werden Schwächungswerte von Röntgenstrahlung
aus verschiedenen Richtungen gesammelt, so dass die räumliche Anordnung
der absorbierenden Strukturen bestimmt werden kann (Wegener, 1996).
Die Röntgenstrahlung wird beim Durchtritt durch die verschiedenen Gewebe unterschiedlich abgeschwächt. Ihnen werden verschiedene Abschwächungskoeffizienten zugeordnet (Tab. 3.7). Die Dichtewerte von Luft (-1000 HU) und Wasser (0 HU) stellen Fixwerte dar, auf die jedes CT-Gerät kalibriert ist. Beim Durchstrahlen einer Schicht werden den einzelnen kleinsten Volumeneinheiten (Voxel) unterschiedliche Dichtemesswerte analog dem Absorptionskoeffizienten zugeteilt. Die Dichtewerte werden in Hounsfield Units (HU) auf einer Skala von -1000 bis +2000 HU ausgedrückt.
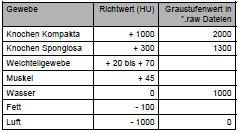
Tab. 3.7: Hounsfield-Einheiten
Im zweidimensionalen CT-Bild werden die Volumeneinheiten in Bildpunkte umgewandelt (Pixel, kleinster errechneter Bildpunkt). Die Wiedergabe der Dichtewerte der einzelnen Pixel erfolgt in Grautönen. Ein Bild enthält 512 x 512 Bildpunkte.
Die in den CT-Schnitten ermittelten Dichtewerte entsprechen somit nicht der physikalischen Dichte, sondern geben den Anteil an Röntgenstrahlen absorbierenden Material (Mineralsalzgehalt) wieder. Durch ein Wasser-Hydroxylapatit- Phantom bekannter Dichte (Wasserdichte 0 HU, Spongiosadichte +300 HU), das bei der quantitativen Messung der Knochendichte mitgescannt wird, ist es möglich, die ermittelten Knochendichtewerte auf Absolutwerte zu kalibrieren, um aussagefähige Werte zu erhalten und Messfehler zu minimieren.
3.5.3 Messungen der Mineralisierungsdichte an der subchondralen Knochenplatte
Die exartikulierten Präparate von Femur und Acetabulum wurden voneinander
getrennt im Computertomographen (CT) (Siemens Somatom AR/ Spiral) auf
Schaumstofflagen gelagert. Die Gelenkflächen lagen vollkommen frei und berührten
einander nicht. Unter den Schaumstofflagen wurde ein Phantom bekannter
Röntgendichte zur Kalibrierung der gemessenen Dichtewerte platziert.
Zunächst wurde ein Übersichtsbild bei feststehender Röhre (Topogramm) angefertigt (Abb. 3.5). Anhand des Topogramms wurden die zu scannenden Bereiche (ROI, region of interest) ausgewählt. Um eine möglichst gute Auflösung zu erhalten, wurde der zu scannende Bereich eingegrenzt, so dass das Präparat formatfüllend abgebildet war. Das Bildfenster wurde auf eine Fensterlage (center) von 700 HU und Fensterbreite (width) von 2000 HU eingestellt, um die subchondrale Knochenschicht detailliert erkennen zu können.
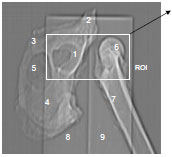
Abb. 3.5: Topogramm, Hemipelvis links, Os femoris rechts, unterlagert vom Phantom.
1 Facies lunata, 2 Os ilium, 3 Os pubis, 4 Os ischii, 5 For. obturatum, 6 Caput ossis femoris,
7 Femurschaft, 8 Phantom, Wasseräquivalent, 9 Phantom, Spongiosaäquivalent, ROI = Region of interest.
Die CT-Bilder wurden in transversaler Schnittebene senkrecht zu den Gelenkflächen von Acetabulum und Femurkopf mit einer Schichtdicke von 1 mm, bei 1 mm Vorschub, 110 kV und 249 mAs angefertigt (Abb. 3.6).
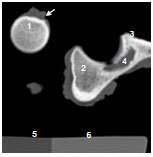
Abb. 3.6: CT-Schnittbild durch Femurkopf (links) und Acetabulum (rechts). Am unteren Bildrand ist das
Phantom zu sehen. 1 Fovea capitis mit Lig. capitis ossis femoris (Pfeil), 2 Pfannendach, 3 Ventralrand
Acetabulum, 4 Fossa acetabuli mit Inc. acetabuli, 5 Phantom, Wasseräquivalent, 6 Phantom, Spongiosaäquivalent.
3.5.3.1 Datenverarbeitung und 3D-Rekonstruktion
Die CT-Datensätze werden vom Computertomographen zunächst als sogenannte
IMAGE-Dateien gespeichert. Für die weitere Verarbeitung werden sie in
das ACR-NEMA 2 Format (DICOM) konvertiert und in Rohbilddateien (*.raw)
umgewandelt.
Im Programm IMAGETOOL (University of Texas Health Science Center, San Antonio) wurden zunächst die Dichtewerte mit Hilfe der Referenzdichtewerte des miteingescannten Phantoms korrigiert. Dazu werden die entsprechenden *.raw-Datensätze in das Programm importiert. Der Bereich des Phantoms wird ausgewählt. Mit dem Befehl „equalize roi“ wird das Programm gestartet. Alle Rohbilddateien werden auf den Eichwert von 300 HU korrigiert.
Die korrigierten *.raw-Dateien bilden die Grundlage für die 3D-Rekonstruktion der Gelenkflächen von Caput ossis femoris und Acetabulum mit dem Visualisierungs- Programm (VTK, Visualisation Toolkit). Bei der 3D-Rekonstruktion werden aus einer Folge von Schichtbildern die Umrisse einer anatomischen Struktur automatisch berechnet und daraus die Oberfläche dreidimensional rekonstruiert. Mit dem Befehl „vtkobject“ werden die *.raw-Dateien in ein dreidimensionales Bild umgerechnet.
In einem zweiten Schritt wird die topographische Verteilung der Mineralisierungsdichte der subchondralen Knochenplatte gemessen. Hierzu werden die Gelenkflächen und die angrenzende subchondrale Knochenplatte manuell in dem im Institut entwickelten Programm MEASURE als sogenannte ROIs (region of interest) markiert. Eine neue Reihe von *.raw-Datensätzen wird dadurch erhalten, in welchen mit dem Befehl „vtkctoam“ die topographische Verteilung der maximalen Knochendichte ermittelt wird. Dazu wird senkrecht zur Oberfläche in einer Eindringtiefe von 1,5 mm unter der Grenzfläche zwischen Gelenkknorpel und subchondraler Knochenplatte der höchste Hounsfield-Wert gesucht. Dieser wird an die Oberfläche der Knochenrekonstruktion projiziert und in Falschfarbenkodierung ausgegeben (MIP, maximal intensity projection).
Die Knochendichtewerte werden in 15 Dichtebereiche zwischen 500-2100 HU eingeteilt. Die verschiedenen Dichtebereiche (jeweils 100 HU) werden mit Falschfarben belegt (Abb. 3.7) und die subchondrale Knochendichteverteilung wird als farbige „Dichtekarte“ auf der Gelenkoberfläche angezeigt.

Abb. 3.7: Skala der Hounsfieldeinheiten (HU) zur Falschfarbenkodierung der verschiedenen
Knochendichtebereiche; rot steht für eine hohe Knochendichte, dunkelblau für eine niedrige Knochendichte.
Für die Auswertung wurden die individuellen Dichtekarten der Gelenkflächen in vier verschiedenen Ansichten dargestellt. Die extreme Krümmung der Gelenkflächen von Facies lunata und Femurkopf machte die realitätsgetreue Abbildung in einer einzigen Ansicht sehr schwierig. Daher wurden Perspektiven von lateral bzw. medial, kranial, kaudal und dorsal gewählt.
3.5.3.2 Summationsbilder
Zur Darstellung der mittleren Knochendichte werden die Dichtewerte auf ein
Normgelenk übertragen. Dies erfolgt mit dem Matching-Programm VTK CISG
Registration Toolkit (Computational Imaging Science Group, King's College
London). Das Normgelenk stellt ein willkürlich ausgewähltes Gelenk dar, das
den Standardtyp eines Hüftgelenkes repräsentiert. Das VTK CISG Programm
passt nach manueller Voreinstellung automatisch den individuellen Bilddatensatz
an den Normdatensatz an. Dabei werden entsprechende Strukturen von
unterschiedlichen Datensätzen übereinander gelegt. Basis für dieses rechenaufwendige
Verfahren sind die *.raw-Datensätze.
Die angeglichenen Bildpunkte werden in eine Microsoft Excel Tabelle überführt und der Mittelwert aus allen Dichtewerten der Acetabulum- und Femurkopf- Gelenkflächen bestimmt. In einem weiteren Schritt werden die Mittelwerte wieder zurückkonvertiert in ein dreidimensionales Summationsbild. Es zeigt den exakten rechnerisch ermittelten Durchschnittswert aus der Summe aller Knochendichtewerte auf der Referenzgelenkfläche an. Dieses Verfahren ermöglicht vor allem die statistische Bearbeitung der Werte, z.B. die Berechnung der Standardabweichung und insbesondere die Anzeige einer gezielten Auswahl von Datensätzen z.B. nach Alter, Rasse und Geschlecht.
Individuell sehr unterschiedliche Gelenkformen limitierten die Auswahl der Hüftgelenke für dieses Verfahren. Insgesamt wurden 26 Acetabula und 32 Femurköpfe untersucht (Anhang Tab. 8.3 und Tab. 8.4).
3.6 Torsionsmessung
Bei der computertomographischen Torsionsmessung am Os femoris (Methode
nach Löer, 1999) wird die Torsion anhand von computertomographisch ermittelten
Koordinaten berechnet.
Die Messung der Femurtorsion dient zur Beurteilung der Gelenkstellung und soll die Bedeutung der Antetorsion des Femurhalses bei den Belastungsverhältnissen im Gelenk aufzeigen.
3.6.1 Untersuchungsgut
Es wurden die linken und rechten exartikulierten, präparierten Oberschenkelknochen
von 18 Hunden verschiedener Rassen, Alter und Geschlecht untersucht (Tab. 3.6).
3.6.2 Methode
3.6.2.1 CT-Schnitte
Für die Untersuchungen wurde ein Computertomograph Somatom AR/Spiral
(Siemens) verwendet. Die Ossa femoris wurden parallel zur Längsachse des
Untersuchungstisches auf Schaumstoff gelagert. Die CT-Aufnahmen wurden
mit einer Schichtdicke von 1 mm, bei einem Tischvorschub von 1 mm, 110 kV
und 249 mAs angefertigt. Ein Bild enthielt 512 x 512 Matrixpunkte. Die Beurteilung
knöcherner Strukturen erfolgte bei einer Fenstermitte von 300 HU und einer
Fensterweite von 1500 HU.
Vor den für die Torsionsmessung notwendigen Schichtaufnahmen (Tomogramme) wurde jeweils ein Topogramm erstellt, das als Übersichtsbild das genaue Festlegen von anatomischen Untersuchungsregionen und die Überprüfung der parallelen Lagerung erlaubt (Abb. 3.8).
Abb. 3.8: Topogramm eines linken und rechten Gliedmaßenpräparats. An den Ossa femoris
sind die verschiedenen Schnittebenen als ROIs 1-4 markiert.
Das Übersichtsbild ist vergleichbar mit einer konventionellen Übersichtsröntgenaufnahme in v-d Projektion. Der Untersuchungstisch bewegt sich bei in 0° Stellung festgestellter Röhre durch die Gantry.
Anhand des Topogramms wurden folgende Regionen nach Löer (1999) festgelegt:
- Femurkopfschnitt – durch den Femurkopf in Höhe des Maximaldurchmessers
- Halsbasisschnitt – durch die Halsbasis in Höhe des Trochanter minor
- Distaler Schaftschnitt – durch den distalen Schaftbereich proximal der Tuberositas supracondylaris lateralis
- Kondylenschnitt – durch die Femurkondylen zwischen mittlerem und oberem Drittel der Fossa intercondylaris
Durch jede der vier Regionen wurden jeweils drei bis fünf Schnitte angefertigt.
Die Schnittbilddatensätze wurden vom Image Dateiformat des Computertomographen in Rohbilddatensätze umgewandelt und an einem konventionellen PC ausgewertet. Im Programm VTK MEASURE wurden die einzelnen CT-Bilder nochmals geladen und die notwendigen räumlichen Koordinaten zur Berechnung des ATW notiert (Abb. 3.9).
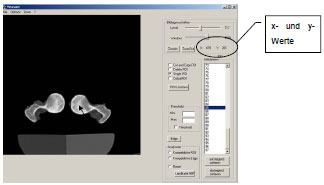
Abb. 3.9: Ablesen der x- und y- Koordinaten im Programm MEASURE.
Dazu werden die Mittelpunkte der anatomischen Fixpunkte mit dem Cursor aufgesucht und die am Bildschirm angezeigten x-, y- und z-Koordinaten abgelesen. Die 14 x-, y- und z-Werte werden in das Computerprogramm eingetragen und der ATW automatisch daraus berechnet.
3.6.2.2 Computerprogramm
Das von Löer (1999) entwickelte Verfahren erlaubt die Berechnung der Femurtorsion
lagerungsunabhängig aus den Daten der vier axialen Computertomographie-
Aufnahmen (Femurkopfmittelpunkt, Halsbasismittelpunkt, Mittelpunkt
im distalen Schaftschnitt, medialer und lateraler Kondylenpunkt) (Abb. 3.10).
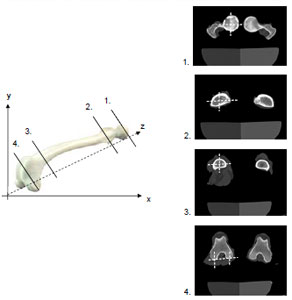
Abb. 3.10: Schnittebenen durch das Os femoris. 1. Femurkopf-Aufnahme,
2. Proximale Schaft-Aufnahme in Höhe des Trochanter minor, 3. Distale Schaft-Aufnahme proximal der
Tuberostias supracondylaris, 4. Kondylen-Aufnahme.
Diese Punkte werden exakt in Form von x-, y- und z-Koordinaten im CT-Bild angegeben. Aus diesen dreidimensionalen Koordinatenpunkten berechnet das Programm trigonometrisch den projizierten Antetorsionswinkel.
3.7 Druckmessungen
Die Druckverteilung und die Größe des Drucks sowie Kontaktflächen im Hüftgelenk
wurden während physiologischer Gelenkstellung (mittlere Standbeinphase
des Gangs) mittels drucksensitiven Films und Silikonabdruckmasse ermittelt.
3.7.1 Untersuchungsgut, Entnahme und Präparation
Es wurden 7 Hüftgelenkpräparate ohne makroskopisch sichtbare Knorpelschäden
von 5 Hunden großer Rassen untersucht (Tab. 3.8). Das Alter der Hunde
betrug zwischen 4-10 Jahren (Durchschnitt 7,5 Jahre), das Körpergewicht lag
zwischen 24-38 kg (Durchschnitt 33,8 kg). Die präparierten Hundehüften wurden
bis zum Tag der Untersuchung eingefroren bei -18 °C gelagert. Um das
Austrocknen des Gelenkknorpels zu verhindern, wurden die Präparate in mit
Phosphatpuffer getränkten Einmaltüchern eingewickelt und in luftdicht verschlossenen
Polyethylenbeuteln aufbewahrt. Etwa 24 Stunden vor der Untersuchung
wurden sie im Kühlraum bei 4 °C aufgetaut. Dabei wurden die Gelenkknorpelflächen
ebenfalls stets mit Phosphatpuffer vor dem Austrocknen geschützt.
Es wurden jeweils die Hemipelves zusammen mit dem Iliosakralgelenk
(Durchtrennung des Os sacrum und der Symphysis pelvina in der Medianen)
und das proximale Drittel des Os femoris entnommen. Weichteile und Muskeln
wurden abpräpariert und die Gelenkkapsel eröffnet. Das Lig. capitis ossis femoris
wurde durchtrennt und weitgehend entfernt. Das Lig. transversum, sowie das
Labrum acetabulare wurden ebenfalls entfernt.
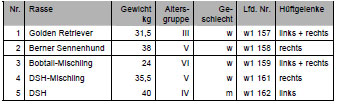
Tab. 3.8: Hunde für Druckversuche
3.7.2 Verwendetes Gerät
Die Untersuchungen wurden an der institutseigenen, unaxialen Materialprüfmaschine
Zwick Z010 (Ulm, Deutschland) durchgeführt (Abb. 3.11). Es wurden
eingespannte Gliedmaßenpräparate nach in vivo gemessenen Werten aus der
Studie Page et al. (1993) physiologisch belastet. Dabei wurde modellhaft die
mittlere Standbeinphase zugrunde gelegt.

Abb. 3.11: Computergesteuerte Materialprüfmaschine Zwick Z010. 1 Kraftmessarm mit Kraftmessdose,
2 frei beweglicher Kugellagerblock mit darüber liegender Stahlplatte.
Die Materialprüfmaschine erlaubt durch genaue Versuchsdefinitionen in der erweiterten Hystereseanwendung des Programms ZWICK TEST EXPERT V 5,0 die computergesteuerte Krafteinleitung. Jede Belastungsstufe wurde mit einer Vorkraft von 2 N bei einer Geschwindigkeit von 2 mm/s computergesteuert angefahren. Die Standardkraft (100% Fmax) wurde kraftgeregelt mit 100 N/s eingeleitet und für eine definierte Zeit (siehe unten) gehalten. Der bewegliche Kraftarm ist an die Kraftmessdose angeschlossen, von der aus die Messdaten übertragen werden.
Der Querbalken der Materialprüfmaschine ist ausschließlich uniaxial in vertikaler Richtung beweglich. Daher musste der Versuchsaufbau derart gewählt werden, dass der Femurkopf von oben in das Acetabulum entsprechend der Richtung der resultierenden Gelenkskraft gepresst wird. Hierfür wurde eine spezielle Testvorrichtung konstruiert.
Auf dem Prüftisch wurde ein translatorisch und rotatorisch frei bewegliches Kugellager montiert. Darüber wurde eine Stahlplatte gelegt, auf der die Probe zu liegen kam. Dies diente zum Ausschluss von Zwangskräften und die Gelenkanteile konnten eine natürliche Position bei der Artikulation einnehmen.
3.7.3 Untersuchte Gelenkstellung
Für die Ermittlung der Druckübertragung und Kontaktflächen an der Materialprüfmaschine
wurden die Hüftgelenkpräparate entsprechend den physiologischen
Gegebenheiten während der mittleren Standbeinphase des Schritts eingespannt.
Während eines Gangzyklus findet die maximale Belastung der Hintergliedmaße
in der mittleren Standphase statt, wenn nur eine der Beckengliedmaßen
Bodenkontakt hat (Dreibeinstand) und die andere nach vorne
schwingt (Allen et al., 1994).
In der mittleren Standphase des Ganges, so ermittelt während der Ganganalyse mittels einer instrumentierten Endoprothese (Page et al., 1993), steht das Os femoris in einem Flexionswinkel von 110° zur Beckenlängsachse in der Sagittalebene (Extension/ Flexion) (Abb. 3.12).
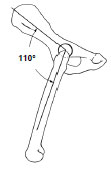
Abb. 3.12: Gliedmaßenwinkelung in Relation zum Becken, Ansicht von lateral,
Flexionswinkel im Hüftgelenk in der Sagittalebene; (Abb. nach Page et al., 1993).
In der Transversalebene (Adduktion/ Abduktion) ist das Femur in einem Winkel von 105° vom Beckenboden abduziert (Abb. 3.13). In dieser Stellung ist das Oberschenkelbein nicht rotiert (Innen-/ Außenrotationswinkel von 0°).
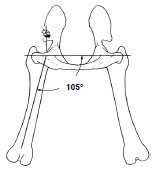
Abb. 3.13: Gliedmaßenwinkelung in Relation zum Becken, Ansicht von kaudal, Abduktionswinkel
im Hüftgelenk in der Transversalebene; (Abb. nach Page et al., 1993).
Die Richtung der Resultierenden R (Netto-Kraft-Vektor) ist dabei nach ventral, kaudal und lateral gerichtet (Abb. 3.14). In der x-y Ebene ist sie mit 20° nach kaudal gerichtet (polar angle θ) und entlang der Femurhalsachse 30° nach lateral (cone angle Φ).
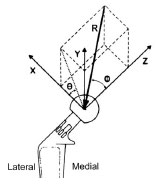
Abb. 3.14: Richtung von R dargestellt am Kopf einer instrumentierten rechten
Hüftendoprothese, die y-Achse würde in dieser Ansicht von kranial nur einen Punkt darstellen,
ist aber zur Verdeutlichung als Achse gezeichnet, nähere Erläuterungen siehe Text (Abb. nach Page et al., 1993).
3.7.4 Berechnung des Versuchsaufbaus
Die Verwendung eines eigenen lokalen femoralen Koordinatensystems bei Angabe
der Hüftgelenkskräfte von Page et al. (1993) machte eine Umrechnung
der angegebenen Kraftvektoren in ein beckenbezogenes, orthogonales Koordinatensystem
für den Versuchsaufbau notwendig. Der Kraftarm der Materialprüfmaschine
kann nur in einer Richtung uniaxial bewegt werden. Daher war es
notwendig, die hüftgelenksbildenden Gelenkanteile derart einzuspannen, dass
der Kraftvektor der Resultierenden genau mit der Bewegungsachse des Kraftmessarms
der Materialprüfmaschine übereinstimmte. Im umgerechneten ortho
gonalen/ universalen Koordinatensystem zeigt die x-Achse nach dorsoventral,
die y-Achse nach kraniokaudal und die z-Achse nach mediolateral.
Page beschreibt die drei Komponenten der Resultierenden (Fx, Fy, Fz) anhand eines Koordinatensystems, das an der Femurhalsachse ausgerichtet ist. Die x- Achse steht senkrecht zum Femurhals in der x-z Ebene. Die y-Achse ist senkrecht zu dieser Achse und liegt in der Sagittalebene (kranial-kaudal). Die z- Achse steht parallel zum Femurhals. Die x-z Ebene definiert die Hals-Schaft- Ebene (Abb. 3.14). Der Polar Winkel θ (20°) und der Cone Winkel Ф (30°) geben die Richtung der Einwirkung des Vektors der Gelenkkraft R auf den Femurkopf wieder.
Diese Art des Koordinatensystems ausgerichtet am Femurkopf macht eine experimentelle Anordnung der Gelenkanteile im Raum nicht möglich. Daher wurden die Werte folgendermaßen in ein orthogonales Koordinatensystem (wie auch bei Bergmann et al., 1984) übertragen.
Aus einem Diagramm der Kraftkomponenten (Page et al., 1993) wurden die Werte der drei Kraftkomponenten der Resultierenden (Fx, Fy, Fz) in der mittleren Standbeinphase des Ganges abgelesen (Abb. 3.15).
Abb. 3.15: Kraftkomponenten von R (Abb. nach Page et al., 1993); Zum Zeitpunkt der mittleren
Standbeinphase setzt sich R aus den unterschiedlichen Kraftkomponenten in der x-, y- und z- Achse zusammen.
γ ist der Winkel, der in der xz-Ebene, den Summenvektor Fxz zu den Vektoren Fx und Fz bildet.
tan y = Fx / Fz = -0,667 / -1,387 = 0,481 (3.1)
arc tan 0,481 = 25,7° (3.2)
Drehung um 45° -> υ + 45° = 70,7°
Winkelsumme im Dreieck 180° (rechter Winkel zwischen x- und z-Achse)
70,7° + 90° + β = 180°
β = 19,3°
Fxz = √(Fz² + Fx² ) (Satz des Pythagoras) (3.3)
Fxz = -1,53904
Fxneu = cos β • Fxz = cos19,3 • 1,53904 = -1,453</p>
Fzneu = sin β • Fxz = sin19,3 • 1,53904 = -0,509 (3.4)
Fyneu = Fy = -0,487
δ ist der Winkel in der xy-Ebene, den der Summenvektor Fxy zu den Vektoren
Fx und Fy bildet.
tanδ = (Fyneu / Fxneu) = (-0,487 / -1,453) = 0,335 (3.5)
arc tan 0,335 = 18,5° (3.6)
Winkelsumme im Dreieck 180° (rechter Winkel zwischen x- und z-Achse)
18,5° + 90° + α = 180°
α = 71,5°
Winkel in xz-Ebene = ν + 45° = 70,7° -> 19,3°
Winkel in xy-Ebene = 71,5° -> 18,5°
Das Oberschenkelbein befindet sich in der lateromedialen Ansicht (Flexion/ Extension) in einem Winkel von 18,5° zur Senkrechten. In der kraniokaudalen Ansicht (Ab-/Adduktion) steht es in einem Winkel von 19,3° zur Senkrechten.
Die Ausrichtung des Beckens ergibt sich aus folgenden Werten:
Femurlängsachse und Beckenlängsachse stehen in einem Winkel von 110°
zueinander. Das erfordert eine Neigung des Hemipelvis in seiner Längsachse
um 51,5° von der Senkrechten (bzw. im Winkel von 38,5° von der Horizontalen).
Mit dem Femur in Flexionsstellung von 18,5° ergibt sich somit ein Flexionswinkel
von 110° (90° - 18,5° = 71,5°; 71,5° + 38,5° = 110°). Der Abduktionswinkel
von 105° wird reproduziert indem die Holzscheibe, auf der das Becken aufgeschraubt
ist, auf einem Keil befestigt wird in einem Neigungswinkel von 34,3°.
Dies ergibt mit dem „abduzierten“ Femur im Winkel von 19.3° einen Abduktionswinkel
von insgesamt 105° (90° - 19,3° = 70,7°; 70,7° + 34,3° = 105°).
3.7.5 Versuchsaufbau
Das Hemipelvis wurde so ausgerichtet, dass die Richtung der Krafteinleitung in
der uniaxialen Prüfmaschine exakt mit der Verlaufsrichtung der Gelenkresultierenden
in der mittleren Standbeinphase übereinstimmte.
Nach Exartikulation wurde jedes Os femoris in seiner Länge gekürzt und in ein 7 cm langes Prüfgefäß (Aluminiumbecher) mittels Schablonen in Schnellzement (Faust® Schnellzement) eingebettet, so dass der Femurkopf in der vorher genau berechneten Winkelung (siehe oben) zur Artikulation mit dem Acetabulum aus dem Becher herausragte. Vier Schrauben wurden in den kortikalen Femurschaft in Kreuzanordnung angebracht, um die Lage im Schnellzement zusätzlich zu stabilisieren. Das Os femoris wurde mit seiner Längsachse in einem Winkel von 18,5° zur Senkrechten in der Sagittalebene und im Winkel von 19,3° zur Senkrechten in der Transversalebene eingebettet.
Die Beckenhälfte wurde dermaßen an der Symphysis pelvina, an der Ala ossis ilii und am Os sacrum auf eine im entsprechenden Winkel schräg stehenden Holzplatte geschraubt, dass die Längsachse, angelegt in der Mitte der Iliumflügel, einen Winkel von 51,5° zur Senkrechten bildete. Unter dem Os pubis und seinem ventralen Anteil wurde das Becken durch einen Holzvorsprung unterstützt, um die Zugkräfte auf die Schrauben am Symphysenrand möglichst gering zu halten. Die Holzplatte mit dem montierten Hemipelvis wurde mit einem Holzkeil im Winkel von 34,3° schräg auf einer Bodenplatte befestigt. Diese ruhte auf der Stahlplatte über dem frei beweglichen Kugellager auf dem Prüftisch (Abb. 3.16).

Abb. 3.16: Einspannvorrichtung für das Becken, Ansicht von schräg-vorne, Winkelung des Holzkeils.
Der Becher mit dem eingegossenen Femurkopf wurde in einem nächsten Schritt am beweglichen Kraftmessarm der Materialprüfmaschine befestigt. Beide Gelenkanteile wurden so in die Maschine eingespannt, dass die Richtung der eingeleiteten Kraft durch den Querbalken der Materialprüfmaschine mit der Resultierenden aus der Studie von Page übereinstimmte.
3.7.6 Belastung
Es wurden Belastungen in neun Stufen relativ zum Körpergewicht in der in vivo
ermittelten Richtung eingeleitet, so dass unterschiedliche absolute Kräfte für die
einzelnen Hunde verwendet wurden. Die absoluten Kräfte lagen zwischen minimal
59 N und maximal 1597 N.
Tab. 3.9: Belastungsstufen in Abhängigkeit von der Körpermasse
3.7.7 Kontaktflächen
Die Ermittlung der Kontaktflächen im Hüftgelenk erfolgte mit Silikonabdruckmasse
aus der Zahnmedizin (hohe Abformgenauigkeit), die im belasteten Gelenk
während verschiedener Belastungsstufen aushärtete. Es wurden Abdruckserien
für 7 Hüftgelenke erstellt unter Belastungen von 25, 50, 75, 100, 150,
200, 250, 300, 400% des Körpergewichts.
3.7.7.1 Erstellung von Abdruckserien mit Silikonabformmasse
Eine bestimmte Menge der 2-Komponenten Silikonmasse (Dental ADS 562
A/B, Wacker Chemie) wurde im Verhältnis 1:1 angerührt und nach gründlichem
Mischen innerhalb von 30 Sekunden in das Acetabulum verbracht. Um der
Masse ein Austreten durch die Inc. acetabuli zu erlauben, wurden Reste des
Lig. capitis femoris, sowie das Lig. transversum bei der Vorbereitung der Gelenkanteile
sorgfältig entfernt.
Die beiden Gelenkanteile wurden in ihrer natürlichen Stellung zusammengebracht und mit der entsprechenden Kraft (siehe Tabelle oben) belastet. Diese Kraft wurde innerhalb von 30 Sekunden eingeleitet, die Zeit, in der das Material noch gut formbar ist. Für weitere 570 Sekunden wurde die Stellung auf 100% dieser Kraft zur Aushärtung des Materials gehalten (insgesamt 10 Minuten Aushärtezeit). Danach wurde das Gelenk wieder entlastet und die Abdrücke vorsichtig entfernt.
3.7.7.2 Auswertung der Abdruckserien
Um die Größe der Kontaktflächen zu ermitteln, wurden die Knochen der Prüfpräparate
ausgekocht (3 Tage bei 80 °C), um sie von Knorpel und Weichteilresten
zu befreien.
Die knöchernen Gelenkflächen von Acetabulum und Femurkopf wurden in flüssiges Paraffin (Paraplast Plus®, Sherwood Medical Co., St. Louis, U.S.A.) getaucht. Auf die abgekühlte Paraffinschicht wurde im Bereich der Gelenkfläche zweimal eine weiße Deckfarbe (Alpina® Systemcolor Dispersionsfarbe) aufgetragen. Die Silikonabdrücke wurden auf die derart vorbereiteten Gelenkflächen aufgesetzt und die Kontaktflächen mit einem roten Stift markiert. Als Kontaktflächen wurden die Bereiche des Silikonabdrucks definiert, aus dem die Abformmasse komplett ausgedrückt worden war (Abb. 3.17 und Abb. 3.20).
Abb. 3.17: Femurkopf mit Silikonabdruck, Kranialansicht.
Abb. 3.18: Femurkopf mit Paraffinkappe, auf der die Kontaktfläche rot markiert wurde.

Abb. 3.19: Paraffinkappe mit Entlastungsschnitten, auf schwarzem Tonpapier aufgebügelt.
Die weiß-rot gefärbten Paraffinkappen wurden am Gelenk fotografiert (Abb. 3.18 und Abb. 3.21) und danach mit einem Skalpell abgenommen. Entlastungsschnitte ermöglichten das Auffalten der halbkugelförmigen Gelenkflächenreplikate und das Aufbügeln (Wärmeplatte) auf schwarzes Tonpapier (Abb. 3.19 und Abb. 3.22).
Abb. 3.20: Acetabulum mit Silikonabdruck, Lateralansicht.
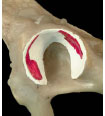
Abb. 3.21: Acetabulum mit Paraffinhäutchen, auf dem die Kontaktfläche rot markiert wurde.
Abb. 3.22: Paraffinhäutchen des Acetabulum, mit Entlastungsschnitten, auf schwarzem Tonpapier aufgebügelt.
Die Kontaktflächen wurden digital eingescannt und ihre Größe am PC mit einem Bild Analyse Programm (IMAGETOOL) ausgewertet. Das Verhältnis der Kontaktfläche zur gesamten Gelenkfläche wurde für jede Belastungsstufe ermittelt.
3.7.7.3 Messung der Reproduzierbarkeit
Zur Messung der Reproduzierbarkeit wurden 7 Abdrücke von einem Hüftgelenk
unter gleicher Belastung von 200% des Körpergewichts (470,9 N) angefertigt.
Sie wurden wie oben genannt ausgewertet. Die Methode wies eine hohe Reproduzierbarkeit
auf, der Varationskoeffizient betrug 5% für beide Gelenkflächenanteile.
3.7.8 Drucksensitiver Film – Darstellung der Druckverteilung und Quantifizierung des Druckes
Mit drucksensitivem Film (Fuji Prescale Film, Tokyo, Japan), der in den Gelenkspalt
eingelegt wird, werden besonders belastete Abschnitte der Gelenkfläche
und die Höhe der Druckbelastung für diese Bereiche quantitativ ermittelt. Die
Ergebnisse wurden digitalisiert und am Computer ausgewertet.
3.7.8.1 Film
Der Fuji Prescale Film (Two sheet type) wurde in 2 Empfindlichkeiten verwendet:
Super Low Pressure Type (Messbereich zwischen 0,5-2,5 MPa) und Low
Pressure Type (Messbereich zwischen 2,5-10 MPa). Der Film ist 0,2 mm dick
und besteht aus 2 Polyesterfolien, von denen eine mit einer Chemikalie gefüllten
Mikrokügelchen unterschiedlicher Größe und die andere mit einer Entwicklungssubstanz
beschichtet ist. Wenn die beiden Folien zusammengepresst
werden, platzen die Mikrokügelchen und ihr Inhalt wird durch das Material der
zweiten Folie zu einem roten Farbstoff entwickelt. Die Intensität der Rotfärbung
steht in einem annähernd linearen Zusammenhang zum verwendeten Druck.
3.7.8.2 Versuch
Im Druckversuch wurden die ersten 3 Belastungsstufen mit dem Super Low
Pressure Type Film gemessen, die Belastungsstufen 3-9 mit dem Low Pressure
Type Film. Belastungsstufe Nummer 3 wurde mit beiden Filmen gemessen.
Für jedes zu testende Gelenk wurden Schablonen der Facies lunata aus Alufolie gefertigt, die an die individuelle Größe und Krümmung der Gelenkfläche angepasst waren (Abb. 3.23). Anhand der Schablonen wurden die 2 Lagen der Druckmessfolien individuell für jedes Gelenk vorbereitet. Um möglichst artefaktfreie Messungen zu erhalten, wurden die beiden korrespondierenden Filmstücke am Rand zur Fossa acetabuli sternförmig eingeschnitten.

Abb. 3.23: Form des zugeschnittenen Filmstücks.
Die zwei Anteile der drucksensitiven Folien wurden zwischen zwei 0,1 mm dünnen Polyethylenfolien zum Schutz vor Feuchtigkeit fixiert, da der Film feuchtigkeitsempfindlich ist. Anschließend wurden sie schonend in die Facies lunata eingepasst und der Femurkopf in das Acetabulum abgesenkt. Die maximal eingeleitete Kraft (25, 50, 75, 100, 150, 200, 250, 300, 400% des Körpergewichts) wurde nach 30 Sekunden erreicht und für 30 weitere Sekunden gehalten.
Danach wurde das Gelenk wieder entlastet. Der gefärbte Film wurde aus dem Gelenk entfernt, die beiden Filmfolien voneinander vorsichtig getrennt und die rot gefärbte Folie auf schwarzen Fotokarton zur weiteren Auswertung fixiert. Zwischen den Belastungsversuchen wurden die Knorpeloberflächen mit Pufferlösung feucht gehalten, um einem Feuchtigkeitsverlust vorzubeugen und die Regeneration des Knorpels zu ermöglichen.
3.7.8.3 Auswertung der Druckmessfolie
Die Fuji-Filme wurden digitalisiert und mit einem Bildanalyseprogramm (IMAGE
TOOL) in falschfarbene Bilder konvertiert. Um die Rotfärbung verschiedenen
Druckintensitäten gegenüberstellen zu können wurde ein Eichstreifen in gleicher
Weise mit Falschfarben belegt. Somit konnte die Intensität der Rotfärbung
exakt einem entsprechenden Druck in MPa (N/mm²) zugeordnet werden.
3.7.8.4 Messung der Reproduzierbarkeit
Zur Messung der Reproduzierbarkeit wurden 7 Filme in einem Hüftgelenk unter
gleicher Kraft von 200 % des Körpergewichts (471 N) belastet und derselben
Auswertung unterworfen. Es konnte bei allen 7 Wiederholungen die gleiche
Verteilung der maximalen Kontaktdrücke reproduziert werden. Damit ist dieses
Verfahren ausreichend genau wiederholbar.
4 Ergebnisse
4.1 Anatomisch-makroskopische Untersuchung
Von den insgesamt 164 untersuchten Hunden schieden 121 Hunde (74%) aufgrund
von pathologischen Veränderungen an einem oder beiden Hüftgelenken
für weitere Untersuchungen aus (siehe Anhang Tab. 8.1 und Tab. 8.2). Die pathologischen
Veränderungen beinhalteten Schäden verschiedener Grade an
Gelenkknorpel (Usuren) und seiner unmittelbaren Umgebung (Kapselverschwartungen,
Exostosen, Corpora libera), Hüftgelenkdysplasie (HD) und
Arthropathia deformans sowie offensichtlich vorgenommene Eingriffe an Hüftund
Kniegelenk (Prothese, OP).
91 Hunde (75%) wurden wegen Knorpeldegenerierungsschäden und Osteophyten, 30 Hunde (25%) aufgrund einer HD und Arthropathia deformans ausgeschlossen.
4.1.1 Einteilung und Verteilungsmuster von Knorpelschäden
Bei den Hunden mit Knorpelschäden fanden sich Hunde unterschiedlichster
Rassen. Besonders gehäuft ließen sich allerdings Knorpelveränderungen bei
den Rassen DSH (32n), Berner Sennenhund (8n), Collie (8n), Retriever (6n)
und Terrier (6n) feststellen. Das Körpergewicht der Hunde lag zwischen 7 und
60,5 kg. Das Geschlechterverhältnis war mit 58 Rüden zu 33 Hündinnen ungleich
verteilt. Das Alter der Hunde lag zwischen 2 und 12+ Jahren (Durchschnitt
6 Jahre) (Anhang Tab. 8.1).
Lokalisation im Acetabulum
Degenerative Veränderungen des Gelenkknorpels im Acetabulum sind meist in
der Mitte des kranialen Bereichs (33,9%) und im Hinterhorn (40,1%) des Acetabulum
zu finden (Tab. 4.1 und Abb. 4.1). Die betroffenen Stellen haben eine
kreisrunde oder unregelmäßig abgerundete Form, in fortgeschritteneren Fällen
eine länglich ovale, bogenförmige Gestalt. Die Grenzen zum gesunden Knorpelgewebe
sind scharf begrenzt.

Tab. 4.1: Lokalisation der Veränderungen im Acetabulum (Mehrfachnennungen pro Gelenkfläche möglich)
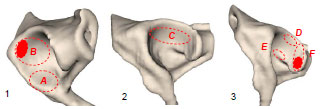
Abb. 4.1: Schematische Darstellung der Lokalisation der Knorpelschäden A-F in einem linken
Acetabulum, Ansicht von 1 kaudolateral, 2 lateral, 3 kraniolateral; A Schäden am Vorderhorn,
B an der Kraniodorsalfläche, C im Pfannendach, D am Übergang zum Hinterhorn dorsal, E
ventral, F Schäden am Hinterhorn; tief angefärbte Bereiche bezeichnen die Stellen der häufigsten Lokalisation.
Lokalisation am Femurkopf
In vielen Fällen treten Knorpelveränderungen am Caput ossis femoris um den
Rand der Fovea capitis (29,7%) auf. Ferner werden kreisförmige Knorpelusuren
vor allem auf der kranialen (20,7%) und kaudalen (49,6%) Artikulationsfläche
des Femurkopfes gefunden. Knorpelläsionen der Grade 3 und 4 befinden sich
zumeist an der Kaudalfläche. Erst in fortgeschritteneren Fällen ist auch der dorsale
Teil des Femurkopfes in die arthrotischen Veränderungen mit einbezogen.
Vor allem ausgedehnte, breitflächige Schäden sind hier zu sehen.
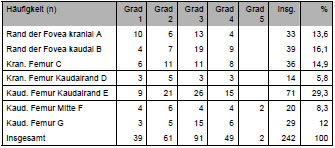
Tab. 4.2: Lokalisation der Veränderungen am Caput ossis femoris (Mehrfachnennungen pro Gelenkfläche möglich)
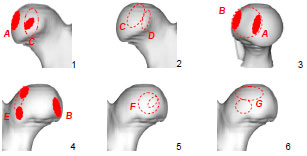
Abb. 4.2: Schematische Darstellung der Lokalisation der Knorpelschäden A-G am Femurkopf; 1-2 Ansicht
von kranial, 3 Ansicht von medial, 4-6 Ansicht von kaudal; A,C,D Schäden an der Kranialfläche, A, B am
Rand der Fovea capitis, E-G an der Kaudalfläche; tief angefärbte Bereiche stellen Orte häufiger,
massiver Schädigungen dar.
Bei der Beurteilung der Knorpelveränderungen im Hüftgelenk wurde festgestellt, dass Knorpelschäden insgesamt und in stärkerem Ausmaß häufiger am Caput ossis femoris vorkommen.
4.1.2 Hüftgelenke mit Dysplasie und Arthrose
Unter den Hunden mit Hüftgelenkdysplasie (HD) und Arthropathia deformans
war besonders häufig der Deutsche Schäferhund vertreten (43%). Aber auch
Hunde anderer Rassen, vorwiegend jedoch großer Rassen, waren von der
Dysplasie betroffen. Das Durchschnittsalter der Hunde betrug 7 Jahre (zwischen
2 und 12+ Jahren) und das mittlere Körpergewicht lag bei 35,5 kg (zwischen
8,5 und 57 kg). Bei der Geschlechterverteilung überwogen die männlichen
Hunde (Anhang Tab. 8.2).
4.2 Spaltlinien
Da sich Kollagenfasern in Richtung ihrer größten Zugfestigkeit ausrichten, kann
durch ihren Verlauf eine eventuell vorhandene langfristige Dehnungsspannung
im Gelenk nachgewiesen werden. Es wurde die Vorzugsrichtung der Kollagenfasern
im Gelenkknorpel und im entkalkten subchondralen Knochen flächendeckend
sichtbar gemacht.
Alle Ansichten wurden auf die linke Körperseite projiziert (rechte Hüftgelenke wurden gespiegelt) um zu einer einheitlichen Auswertung zu gelangen.
4.2.1 Spaltlinien der subchondralen Knochenplatte
Die Spaltlinien in allen sieben untersuchten Hüftgelenken wiesen ein charakteristisches,
nahezu identisches Verlaufsmuster auf.
4.2.1.1 Acetabulum
Im Acetabulum ist ein einheitliches Verteilungsmuster der Spaltlinien erkennbar.
An der Facies lunata des Acetabulum ordnen sich die Spaltlinien in Vorderhorn
und dem kranialsten Anteil parallel bogenförmig mit einer deutlichen Vorzugsrichtung
in sagittaler ventrodorsaler Ausrichtung an (Abb. 4.7).
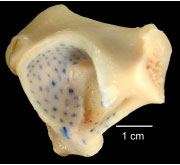
Abb. 4.7: Kranialfläche eines linken Acetabulumpräparats; die Spaltlinien in
der subchondralen Knochenplatte verlaufen in ventrodorsaler Richtung auf das Pfannendach zu.
Am Übergang zum Pfannendach folgen die Spaltlinien bogenförmig den Rändern des Pfannendachs, um parallel zu ihnen zu verlaufen (Abb. 4.8). Am Übergang zum Hinterhorn zeigt sich ein abrupter Richtungswechsel der Spalten. Sie orientierten sich in transversaler Richtung und verbinden die Ränder des hier engsten Teiles der Facies lunata auf kürzestem Wege. In der Peripherie des Vorder- und Hinterhorns der Artikulationsfläche richten sich die Spaltlinien radiär zum Rand hin aus.
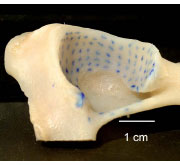
Abb. 4.8: Dorsalfläche (Pfannendach) eines linken Acetabulumpräparats; die
Spaltlinien der subchondralen Knochenplatte zeigen einen kraniokaudalen Verlauf.
Auch der nicht zur Artikulationsfläche gehörende, unter dem Lig. transversum liegende Knochensteg unter der Inc. acetabuli zeigt eine Richtung der Spaltlinien parallel zu seiner Längsachse (Abb. 4.9).
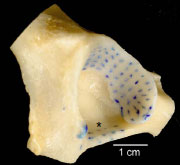
Abb. 4.9: Kaudalfläche eines linken Acetabulumpräparats; die Spaltlinien
der subchondralen Knochenplatte zeigen einen abrupten Richtungswechsel nach mediolateral, am Hinterhornrand
ist eine radiäre Ausrichtung zu beobachten, die Spaltlinien verlaufen am Knochensteg
(*) ventral der Fossa acetabuli in sagittaler Richtung.
4.2.1.2 Os femoris
Die Spaltlinien am Femurkopf sind bis auf ein radiäres Muster am Rand der Fovea
capitis diffus angeordnet, was auf eine ausschließliche Druckbelastung
hinweist. Die Einstiche mit der Metallnadel bilden keine Spalten, sondern haben
eine punkt- oder sternförmige Form. Vereinzelt bilden Einstiche Linien aus, sie
zeigen dabei aber kein Muster (Abb. 4.10 und Abb. 4.11).
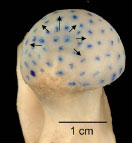
Abb. 4.10: Medialansicht eines linken Femurkopfpräparats; am Rand der
Fovea capitis ossis femoris sind die Spalten radiär angeordnet, die Pfeile verdeutlichen< diese Ausrichtung.
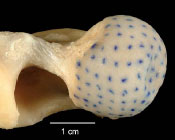
Abb. 4.11: Dorsalansicht eines linken Femurkopfpräparats; es ist kein Muster in der Anordnung der Spalten erkennbar.
4.2.2 Knorpelspaltlinien
In den 40 untersuchten Hüftgelenken wurde ein konstantes, typisches Verlaufmuster
der Spaltlinien gefunden. Sie verlaufen unabhängig von Alter und Geschlecht
der Individuen. Das Spaltlinienbild einer Gelenkfläche ist charakteristisch
gekennzeichnet durch Art, Zahl und Lage seiner singulären Punkte.
Die Spaltlinien, die durch einen Einstich mit einer runden Nadel in den Knorpel produziert wurden, waren fast immer länglich. Sie haben eine typische gerade Form.
Knorpelschäden auf einer Gelenkfläche haben keine Auswirkung auf die Spaltlinien der übrigen Gelenkfläche. Stellen mit offensichtlichen Läsionen zeigen eine durchgängige Anfärbung des Knorpels, Spaltlinien sind hier nicht erzeugbar.
4.2.2.1 Acetabulum
In allen Acetabula ist ein einheitliches charakteristisches Verlaufsmuster der
Spaltlinien erkennbar. Im kranialen Teil des Acetabulum verlaufen die Spalten
in konzentrischen, bogenförmigen Linien in Richtung auf das Pfannendach zu.
Im kranioventralen Abschnitt des Vorderhorns befindet sich ein singulärer attraktiver
Punkt, der zirkulär von Spaltlinien umfahren wird. Am äußeren Gelenkrand
des kraniolateralen Anteils liegt ein zweiter singulärer attraktiver Punkt
(Abb. 4.12). Ihm gegenüber, zwischen Vorderhorn und Pfannendach, laufen die
Spaltlinien am der Fossa acetabuli benachbarten medialen Gelenkrand konvex
bogenförmig von zwei Seiten zusammen (ein repulsiver singulärer Punkt). Im
Pfannendach verbinden die Spaltlinien den lateralen und medialen Gelenkrand.
Sie verlaufen parallel in leicht bogenförmiger Krümmung (Abb. 4.13). Sie biegen
am Übergang zum Hinterhorn in Richtung seiner Spitze um und ordnen sich
dort am lateralen Pfannenrand spiralförmig an (ein attraktiver singulärer Punkt)
(Abb. 4.14).
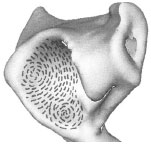
Abb. 4.12: Schematische Darstellung der Spaltlinien des Gelenkknorpels an der Kranialfläche
eines linken Acetabulum; an Vorderhorn und am kraniolateralen Rand sind die Spaltlinien zirkulär angeordnet.
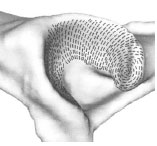
Abb. 4.13: Schematische Darstellung der Spaltlinien des Gelenkknorpels an der Dorsalfläche
eines linken Acetabulum; im Pfannendach verlaufen die Spaltlinien in transversaler Richtung.
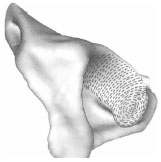
Abb. 4.14: Schematische Darstellung der Spaltlinien des Gelenkknorpels an der Kaudalfläche
eines linken Acetabulum; die Spaltlinien ordnen sich am kaudoventralen Rand spiralförmig an.
An der kraniomedialen Fläche der Facies lunata, die in direkter Nachbarschaft zur Fossa acetabuli liegt, befindet sich häufig ein neutrales Feld, in dem sich nur schwer einzelne Spaltlinien erzeugen lassen, obwohl makroskopisch keine Läsionen sichtbar sind. Hier finden sich oft Knorpelerweichungen. Dieses neutrale Feld trifft mit der Lage des repulsiven singulären Punktes zusammen. Oft sind sie vergesellschaftet mit Einziehungen des inneren Pfannenrandes am Übergang von Vorder- zu Hinterhorn.
4.2.2.2 Os femoris
Die Spaltlinien am Femurkopf sind v. a. auf der Dorsalfläche des Femurkopfes
in geraden Bahnen angeordnet, die von medial nach lateral verlaufen (Abb.
4.18). Von der Fovea capitis strahlen sie radiär in Richtung der lateralen Gelenkflächenränder
aus (Abb. 4.16). An der Kranialfläche ordnen sich die Spaltlinien
am mediodistalen Rand haarnadelförmig an. Hier befindet sich ein attraktiver
singulärer Punkt (Abb. 4.15). Die Spaltlinien verlaufen ebenso an der Kaudalfläche
am laterodistalen Bereich (Abb. 4.17). Medial davon treffen sich die
Spaltlinien in konvexen Bahnen von drei Seiten an einem repulsiven singulären Punkt.
Abb. 4.15: Schematische Darstellung der Spaltlinien des Gelenkknorpels an der Kranialfläche des
Caput ossis femoris; am mediodistalen Gelenkrand ordnen sich die Spaltlinien zirkulär an.
Abb. 4.16: Schematische Darstellung der Spaltlinien des Gelenkknorpels an der Medialfläche
des Caput ossis femoris; um die Fovea capitis herum sind die Spalten strahlenförmig angeordnet.
Abb. 4.17: Schematische Darstellung der Spaltlinien des Gelenkknorpels an der Kaudalfläche des
Caput ossis femoris; am laterodistalen Gelenkrand ordnen sich die Spaltlinien zirkulär an.

Abb. 4.18: Schematische Darstellung der Spaltlinien des Gelenkknorpels an der Dorsalfläche des
Caput ossis femoris; geradliniger Verlauf der Spaltlinien, der die Gelenkränder auf kürzestem Weg verbindet.
4.3 CT-OAM der subchondralen Knochenplatte
Ein charakteristisches Verteilungsmuster der relativen subchondralen Knochendichte
ist in allen 60 untersuchten Gelenkflächen erkennbar. Die proximale
Gelenkfläche (Acetabulum) ist im Durchschnitt höher mineralisiert (100-200 HU)
als der distale Gelenkanteil (Femurkopf).
4.3.1 Individuelle Rekonstruktionen
4.3.1.1 Acetabulum
Das Acetabulum zeigt ein Verteilungsmuster der subchondralen Knochendichte
mit drei Dichtemaxima. Ein Knochendichtemaximum befindet sich im Kaudalhorn.
Es kann sich bis auf das Pfannendach ausdehnen. Ein zweites Maximum
liegt im Pfannendach. Die Knochendichte beträgt dort maximal 1800-2100 HU.
Ein drittes Maximum befindet sich im Vorderhorn. Stärker mineralisiert sind v. a.
die äußeren Gelenkränder. Ein nicht zur Gelenkfläche gehörender Teil des Acetabulum,
der Knochensteg unterhalb des Lig. transversum stellt ebenso einen
Bereich mit sehr hoher Knochendichte dar. Ein Dichteminimum findet sich im
kraniomedialen Anteil der Facies lunata am Übergang von Vorder- zu Hinterhorn
und am inneren Gelenkrand in Nachbarschaft zur Fossa acetabuli, mit
Werten zwischen 800 und 1300 HU.
Auffällig waren altersbedingte Unterschiede in der Mineralisierungsdichte. So bewegt sich ein ca. 6-8 Jahre alter Hund zwischen Knochendichtewerten von >2100 bis 500 HU (Abb. 4.19). Ein ca. 2-jähriger Hund dagegen weist Maximalwerte von nur 1700 HU auf (Abb. 4.20). Das Verteilungsmuster der relativen Knochendichte bleibt dabei gleich.
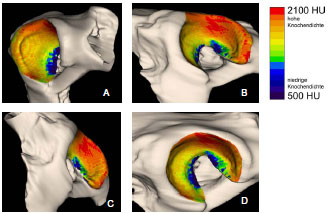
Abb. 4.19: Verteilungsmuster der subchondralen Knochendichte im Acetabulum eines ca.
6 Jahre alten, männlichen Dobermanns; A Kranialfläche, B Dorsalfläche, C Kaudalfläche,
D gesamte Gelenkfläche im Überblick.
Unter den individuell rekonstruierten Gelenkflächen gab es feinste unterschiedliche Abstufungen in der Mineralisierungsdichte und in der Form der Facies lunata. Sie halten jedoch alle das oben genannte Muster mehr oder weniger ein, auch wenn sie sich innerhalb anderer Knochendichtewerte bewegen.
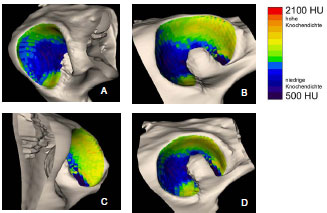
Abb. 4.20: Verteilungsmuster der subchondralen Knochendichte im Acetabulum eines ca.
2 Jahre alten, männlichen Mischlingshundes; A Kranialfläche, B Dorsalfläche, C Kaudalfläche,
D gesamte Gelenkfläche im Überblick
4.3.1.2 Caput ossis femoris
Am Femurkopf befindet sich ein Dichtemaximum am Bandansatz des Lig. capitis
ossis femoris. Darüber hinaus ist der äquatoriale Bereich an der kranialen
und kaudalen Gelenkfläche stärker mineralisiert. An Kranial- und Kaudalfläche
sind je zwei Dichtemaxima zu erkennen, die ineinander übergehen können. Die
Dichtewerte nehmen konzentrisch zu den Randbereichen hin ab. Der Dorsalteil
des Caput ossis femoris ist dagegen in allen Gelenken ein Bereich minimaler
Mineralisierung. Dies deutet darauf hin, dass dieser Anteil weniger belastet ist,
als die Kranial- und Kaudalfläche.
Wie beim Acetabulum, gibt es beim Caput ossis femoris individuelle Unterschiede in der Mineralisierungsdichte und Form der Gelenkfläche, die regelhafte Verteilung der Knochendichte ist jedoch bei allen untersuchten Gelenken vorhanden.
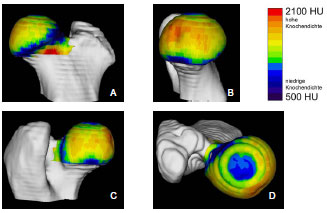
Abb. 4.21: Knochendichteverteilung am Femurkopf eines Zwergschnauzer-Mischlings, ca.
4 Jahre alt, weiblich; A Kranialfläche, B Medialfläche, C Kaudalfläche, D Dorsalfläche.
Ältere Hunde weisen eine höhere Knochendichte auf als jüngere Hunde, die bis zu einem Alter von ca. 2 Jahren relativ geringe Mineralisierungswerte zwischen 500 und 1500 HU zeigen (Abb. 4.21 und Abb. 4.22).
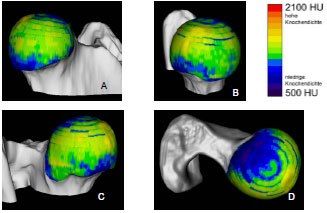
Abb. 4.22: Knochendichteverteilung am Femurkopf eines Berner Sennenhund-Mischlings, ca.
2 Jahre alt, männlich; A Kranialfläche, B Medialfläche, C Kaudalfläche, D Dorsalfläche.
4.3.2 Summationsbilder
4.3.2.1 Acetabulum
Eine Auswahl an Hüftpfannen wurde unabhängig von Rasse, Alter und Geschlecht
übereinander projiziert. Die durchschnittliche Mineralisierungsdichte
liegt zwischen Minimalwerten von 1000 HU und Maximalwerten von 1800 HU.
Das Dichteverteilungsmuster zeigte wie schon bei den individuellen Rekonstruktionen
drei Dichtemaxima (1700-1800 HU). Sie befinden sich an Vorderhorn,
Pfannendach und Hinterhorn (Abb. 4.23).
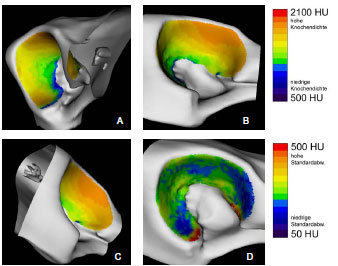
Abb. 4.23: Darstellung der mittleren Knochendichte (A-C) und der Standardabweichung (D) im
Acetabulum; A Kranialfläche, B Dorsalfläche, C Kaudalfläche des Acetabulum, D gesamte Gelenkfläche.
Am inneren Gelenkflächenrand und am Übergang von Vorderhorn zum Pfannendach ist die Mineralisierungsdichte mit 1000-1500 HU am geringsten (Abb. 4.23). Die Standardabweichung zeigt eine gute Übereinstimmung (blau = geringe Standardabweichung) der Knochendichtemaxima in der untersuchten Gruppe von Hunden (Abb. 4.23 D).

Abb. 4.24: Mittelwert der subchondralen Knochendichte im Acetabulum dargestellt an
einer Referenzgelenkfläche; A Gruppe "jung", B Gruppe "mittleres Alter", C Gruppe "alt".
Abhängigkeit der Mineralisierungsdichte vom Alter
In der Gruppe der jüngeren Hunde im Alter von 2-4 Jahren ist besonders der
kraniomediale Bereich des inneren Randes der Facies lunata weniger mineralisiert
im Vergleich zur Gruppe der Hunde mittleren Alters (5-8 Jahre) und der
Gruppe der alten Hunde (9-12+ Jahre) (vgl. Tab. 8.3). Die Mineralisierungsdichte
nimmt mit steigendem Alter zu.
Abb. 4.25: Mittelwert der subchondralen Knochendichte im Acetabulum
der Gruppe "weiblich" dargestellt an einer Referenzgelenkfläche.
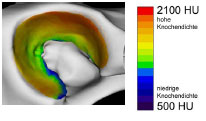
Abb. 4.26: Mittelwert der subchondralen Knochendichte im Acetabulum der Gruppe
"männlich" dargestellt an einer Referenzgelenkfläche.
Abhängigkeit der Mineralisierungsdichte vom Körpergewicht
Die Verteilung der Knochendichte in Abhängigkeit vom Körpergewicht ergab
keine deutlich geringere Mineralisierungsdichte in den unteren Gewichtsklassen
(Abb. 4.27). Während Hunde der Gruppe von 20-29 kg (durchschnittliches Alter
3,4 Jahre) eine deutlich geringere Mineralisierungsdichte mit einem ausgedehnten
Dichteminimum am kraniomedialen inneren Rand der Facies lunata in
Nachbarschaft zur Fossa acetabuli aufweisen, scheint nur ein geringer Unterschied
zwischen den Gruppen 7,5-19 kg (durchschnittliches Alter 6,5 Jahre)
und 30-53 kg (durchschnittliches Alter 9 Jahre) zu bestehen.
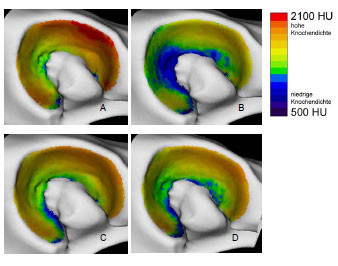
Abb. 4.27: Mittelwert der subchondralen Knochendichte im Acetabulum dargestellt an einer Referenzgelenkfläche;
Hunde A bis 19 kg örpergewicht, B bis 29kg, C ab 30kg Körpergewicht, D DSH.
Das Verteilungsmuster des Deutschen Schäferhundes weist keine Auffälligkeiten auf (Abb. 4.27 D).
4.3.2.2 Caput ossis femoris
Das Summationsbild aller Femurköpfe zeigt Dichteverteilungen, wie schon oben
für die individuellen Gelenkflächen erläutert (Abb. 4.28): Ein Dichtemaximum
(1700 HU) befindet sich an der Ansatzstelle des Lig. capitis ossis femoris. Auf
selber Höhe breitet sich ein „Dichtegürtel“ auf die Kranial- und Kaudalfläche des
Femurs aus. Dabei ist die Kaudalfläche des Femurkopfes stärker (1700 HU)
und über einen ausgedehnteren Bereich mineralisiert, als seine Kranialfläche
(1500-1600 HU). Auf der Kranial- und Kaudalfläche befinden sich wiederum
zwei Dichtemaxima, je lateral und medial, die ineinander übergehen können.
Der Bereich großer Dichte, der sich wie ein Gürtel um die breiteste Stelle des
Femurkopfes legt, verjüngt sich in Richtung der Pole in konzentrischen Abstufungen
(um je 100 HU) bis auf eine Dichte von 1000 HU an den Gelenkrändern.
Die dorsale Gelenkfläche ist am geringsten mineralisiert. Von ihrem lateralen
Gelenkrand aus verdichtet sich ein Bereich mit einer Dichte von 1000 HU in
Richtung auf die Medialfläche in konzentrischen Abstufungen bis auf 1500 HU.
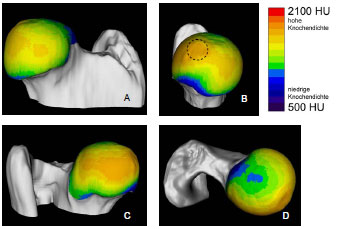
Abb. 4.28: Darstellung der mittleren Knochendichte am Caput ossis femoris, Kranialfläche,
B Medialfläche; gestrichelter Kreis = Fovea capitis, C Kaudalfläche, D Dorsalfläche.
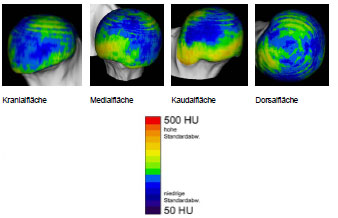
Abb. 4.29: Darstellung der Standardabweichung der mittleren Knochendichte am Caput ossis femoris,
die blauen Bereiche markieren Stellen, die eine niedrige Standardabweichung aufweisen; sie entsprechen den dargestellten
mittleren Knochendichtemaxima im obigen Summationsbild.
Verteilung der Mineralisierungsdichte in Abhängigkeit vom Alter
Die Gelenkfläche des Caput ossis femoris zeigt ein Mineralisierungsmuster in
deutlicher Abhängigkeit vom Alter (Abb. 4.30 bis Abb. 4.32). Die Gelenkflächen
aus der Gruppe „jung“ (2- bis 4-Jährige) weisen mit Maximalwerten von
1500 HU eine insgesamt geringere Mineralisierungsdichte auf. Die Mineralisierungsdichte
nimmt mit steigendem Alter deutlich zu. In der Gruppe „mittleres
Alter“ der 5-8-Jährigen bewegen sich die Maximalwerte in den Bereichen 1800
bis 1900 HU. Bei den Hunden der Gruppe „alt“ (Gruppe der 9-12-Jährigen) sind
die Bereiche der maximalen Dichte von 1800-2100 HU ausgedehnter. Dabei
verlagern sich die Dichtemaxima bei den alten Hunden nach medial, das Dichtemaximum
auf der Kaudalfläche ist deutlich zweigeteilt.
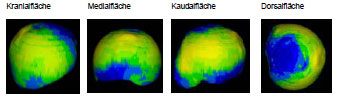
Abb. 4.30: Darstellung der mittleren Knochendichte der Gruppe "jung" am Caput ossis femoris.
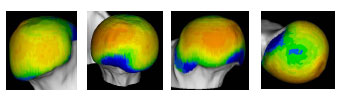
Abb. 4.31: Darstellung der mittleren Knochendichte der Gruppe "mittleres Alter".
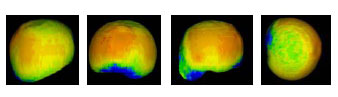
Abb. 4.32: Darstellung der mittleren Knochendichte der Gruppe "alt".
Verteilung der Mineralisierungsdichte in Abhängigkeit vom Geschlecht
Es besteht kein deutlicher Unterschied zwischen der Knochendichte von Hunden
der Gruppe „weiblich“ (Abb. 4.33) und Hunden der Gruppe „männlich“ (Abb.
4.34). Die Gelenkflächen männlicher Tiere (durchschnittliches Alter 6 Jahre,
mittleres Körpergewicht 34,5 kg) weisen geringfügig höhere Dichtemaxima auf,
als weibliche Tiere (durchschnittliches Alter 6 Jahre, mittleres Körpergewicht
25,5 kg).
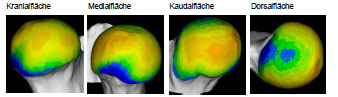
Abb. 4.33: Darstellung der mittleren Knochendichte der Gruppe "weiblich“ (n=10) am Caput ossis femoris.
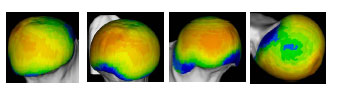
Abb. 4.34: Darstellung der mittleren Knochendichte der Gruppe "männlich" (n=22) am Caput ossis femoris.
Verteilung der Mineralisierungsdichte in Abhängigkeit vom Körpergewicht
Es konnte wie auch schon für das Acetabulum keine Abhängigkeit der subchondralen
Knochendichte vom Körpergewicht festgestellt werden. Wie oben
beschrieben, findet sich eine relativ höhere Knochendichte in der Gruppe der
Hunde bis zu einem Körpergewicht von 19 kg, als in der Gruppe von Hunden
bis 29 kg. Dies dürfte jedoch auf das durchschnittlich höhere Alter der ersten
Gruppe zurückzuführen sein.
4.4 Torsionsmessungen
Die mit dem computertomographischen Verfahren ermittelten Antetorsionswinkel
von 18 Hunden liegen für die rechte Gliedmaße durchschnittlich bei 16,82°
und für die linke Gliedmaße bei 17,62°. Sie weisen eine hohe Variabilität auf
(Tab. 4.3). Der mittlere ATW ist bei großen Rassen größer (18,85°), als bei kleinen
Rassen (10,48°).
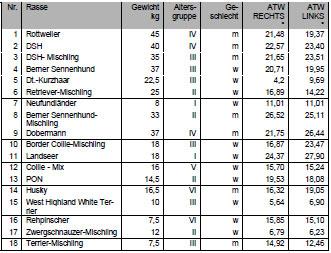
Tab. 4.3: Torsionswerte
4.5 Druckversuche
Es ist ein einheitliches, bi- oder trizentrisches Verteilungsmuster des Gelenkdrucks
bis in hohe Belastungsstufen erkennbar. Besondere Druckbeanspruchungen
bestehen an Vorder- und Hinterhorn. Die Kontaktflächen zeigen bei
geringen Belastungen ein bizentrisches Verteilungsmuster. Sie sind mit zunehmendem
Druck konfluierend.
4.5.1 Kontaktflächen, Gelenkspaltweite
Es wurden die Kontaktflächen und die Gelenkspaltweite mittels Silikonabformmassen
an 7 Hüftgelenken unter ansteigenden Belastungen ermittelt. Die Stellen
des Gelenks, an welchen die Silikonmassen vollständig verdrängt wurden,
wurden als Kontaktflächen identifiziert. Bei geringen Drücken war die Begrenzung
der Kontaktflächen zum weniger belasteten Bereich unregelmäßig, bei
höheren Drücken scharf begrenzt.
Form, Lokalisation und Ausdehnung der Kontaktflächen zeigen individuelle Unterschiede. Kontaktflächen befinden sich am äußeren Rand der Facies lunata und im äquatorialen Bereich des Caput femoris. Unter geringer Belastung sind sie bei 6 von 7 Hunden nicht durchgängig über die ganze Artikulationsfläche, sondern durch einen dünnen Silikonsteg am Übergang von Pfannendach zum Vorderhorn zweigeteilt. An der Facies lunata liegt eine Kontaktfläche am Vorderhorn und eine Kontaktfläche am Hinterhorn und Pfannendach. Am Caput femoris ist die Kontaktfläche an der Dorsalfläche unterbrochen (Abb. 4.35 und Abb. 4.36).

Abb. 4.35: Kontaktflächendarstellung am Gelenkflächenreplikat eines linken Femurkopfes
von einem Bobtail-Mischling (w1 159), 24 kg, weiblich, Belastung 25% KG, die Pfeile verdeutlichen die Richtung, in der
die Kontaktflächen bei höherer Belastung zunehmen, vgl. Bild unten.
Abb. 4.36: Kontaktflächendarstellung am Gelenkflächenreplikat eines linken Acetabulum von
einem Bobtail-Mischling (w1 159), 24 kg, weiblich, Belastung 25% KG, die Pfeile verdeutlichen
die Richtung, in der die Kontaktflächen bei höherer Belastung zunehmen, vgl. Bild unten.
Unter höheren Belastungen dehnen sie sich an beiden Gelenkenden zu einer durchgängigen Kontaktfläche aus (Abb. 4.37 und Abb. 4.38).

Abb. 4.37: Kontaktfläche vom selben Gelenk wie bei der Abb. oben, Belastung hier 250% des KG,
die Kontaktfläche ist ungeteilt und hat sich in Richtung zum medialen Gelenkrand vergrößert.

Abb. 4.38: Kontaktfläche vom selben Gelenk wie bei der Abb. oben, Belastung hier 250%
des KG, die Kontaktfläche ist ungeteilt und hat sich in Richtung zum medialen Gelenkrand vergrößert.
Bei geringen Belastungen berühren sich die Gelenkknorpelflächen am äußeren Pfannenrand des Pfannendachs, während im Zentrum der Facies lunata die Gelenkspaltweite erhalten bleibt. Die Gelenkspaltweite nimmt in Richtung Fossa acetabuli hin bei allen Präparaten zu. Mit ansteigender Belastung dehnen sich die Kontaktflächen sowohl in Richtung Fossa acetabuli, als auch zu den Rändern von Vorderhorn und Hinterhorn hin aus. Dabei konfluieren ab einer Belastung von 100% KG die Kontaktflächen an Vorder-, Hinterhorn und Pfannendach zu einer einzigen durchgängigen Kontaktfläche (Abb. 4.39).
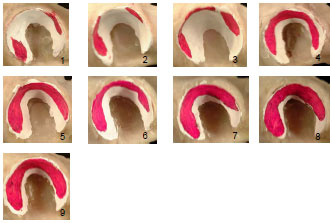
Abb. 4.39: Fotoserie Kontaktflächen, Ansicht eines linken Acetabulum von lateral, Bobtail-Mischling
(w1 159), 24 kg, weiblich, 10 Jahre alt; 1-9 Belastungsstufen rel. zum Körpergewicht; 1) 25%, 2) 50%, 3)
75%, 4) 100%, 5) 150%, 6) 200%, 7) 250%, 8) 300% 9) 400% des Körpergewichts.
Am Caput ossis femoris zeigen die initialen Kontaktflächen an Kranial- und Kaudalfläche sinngemäß das gleiche Verhalten. Sie verschmelzen in der Regel ab einer Belastung von 100% KG auf der Dorsalfläche. Bei höheren Belastungen verbreitern sich die Kontaktflächen analog jenen der Facies lunata in Richtung Äquator des Femurkopfes und verlängern sich gleichzeitig in Richtung auf die distalen Gelenkränder und die Fovea capitis. Ein medialer perifovealer Teil der Knorpelfläche bleibt immer eine Nicht-Kontaktfläche, ebenso wie ein unterschiedlich breiter Streifen am inneren Rand der Facies lunata (Abb. 4.40).
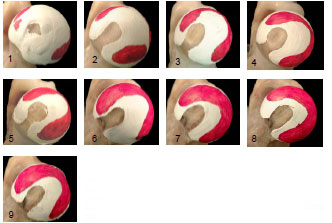
Abb. 4.40: Fotoserie Kontaktflächen, Ansicht eines linken Femurkopfes von medial, Bobtail-Mischling
(w1 159), 24 kg, weiblich, 10 Jahre alt; 1-9 Belastungsstufen rel. zum Körpergewicht; 1) 25%, 2) 50%, 3) 75%,
4) 100%, 5) 150%, 6) 200%, 7) 250%, 8) 300% 9) 400% des Körpergewichts.
Bei einem Hund (w1 162) war gleich von Beginn der Belastungsreihe an eine einzige durchgängige Kontaktfläche vorhanden.
Die digitalisierten Replikate der Gelenkflächen wurden mit IMAGETOOL (siehe Kap. 3.7.7.2) ausgewertet und die Größe der Kontaktfläche in mm² sowie ihre Relation zur Gelenkfläche für jede Druckstufe berechnet.
Die Größe der Gelenkfläche des Os femoris lag zwischen 241 mm² (Golden Retriever, w1 157) und 330 mm² (DSH, w1 162). Die Gelenkfläche der Facies lunata ist geringfügig kleiner als die des Os femoris. Ihre Fläche betrug zwischen 185 mm² (Golden Retriever, w1 157) und 245 mm² (DSH, w1 162). Die durchschnittliche Größe der Gelenkflächen aller 7 untersuchten Hüftgelenke lag bei 295 mm² ± 35 für das Os femoris und bei 222 mm² ± 34 für die Facies lunata.
Der Anteil der Kontaktflächen an der Gesamtgelenkfläche variierte je nach Belastungsstufe. Bei niedrigen Belastungen findet nur ein geringer Kontakt an der peripheren Gelenkfläche statt. Mit steigenden Belastungen nimmt der Anteil der Kontaktfläche in Relation zur Gesamtgelenkfläche zu. Die relative Größe der Kontaktflächen bewegte sich je nach Belastungsstufe zwischen durchschnittlich 24% (Belastungsstufe von 25% KG) und 55% (Belastungsstufe von 400% KG) der Artikulationsfläche für das Os femoris. Die relative Größe der Kontaktflächen für das Acetabulum lag zwischen 37% (Belastungsstufe von 25% KG) bis 84% (Belastungsstufe von 400% KG) der Artikulationsfläche (Tab. 4.4).
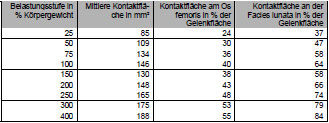
Tab. 4.4: Durchschnittliche Größe der Kontaktflächen im Hüftgelenk und ihr Anteil an der jeweiligen
Artikulationsfläche in Abhängigkeit von der Belastungsstufe
Die Größe der Kontaktflächen nimmt mit der eingeleiteten Kraft proportional zu. Der Anteil der Kontaktfläche an der Gesamtgelenkfläche ist bei Hüftpfanne und Oberschenkelkopf unterschiedlich groß. Die Gesamtfläche der Facies lunata ist kleiner als die des Os femoris, daher ist sie mit einem höheren relativen Anteil an der Lastübertragung beteiligt (Abb. 4.41).
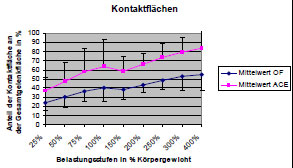
Abb. 4.41: Prozentuale Zunahme der Kontaktflächen an Acetabulum (ACE) und Caput ossis femoris (OF) mit steigender Belastung.
4.5.2 Druckbeanspruchung
An 7 Hüftgelenkpräparaten wurden die Gelenkkräfte als Vielfaches des Körpergewichts
eingeleitet und die Druckverteilung quantitativ und topographisch mittels
FUJI-Druckmeßfolie bestimmt.
Die Filmserie in Abb. 4.42 zeigt exemplarisch die Verteilung der Kontaktdrücke anhand der Form der Facies lunata. Die Druckübertragung beginnt bei geringer Lasteinleitung peripher im Vorder- und Hinterhorn sowie am Übergang von Vorderhorn zum Pfannendach. Mit steigendem Druck vergrößern sich die druckübertragenden Flächen zum Pfannendach und zum Zentrum in Richtung Fossa acetabuli hin und konfluieren schließlich.
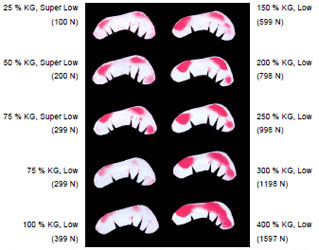
Abb. 4.42: Filmserie einer linken Facies lunata, Golden Retriever, ca. 6 Jahre, weiblich, 31,5 kg,
(w1 157); die Belastungsstufen sind mit % KG definiert, die ersten 3 Belastungsstufen wurden mit dem super low
type Film und die restlichen 7 Belastungsstufen mit dem low type Film durchgeführt.
Fast alle Präparate wiesen Druckmaxima im Vorderhorn, am Übergang von Vorderhorn zum Pfannendach und im Hinterhorn der Facies lunata auf (Typ 1, Abb. 4.43). Bei zwei Gelenken wurde kein Maximum im Vorderhorn des Acetabulum beobachtet (Typ 2, Abb. 4.44).

Abb. 4.43: Fuji-Druckmeßfolie mit Verteilungsmuster des Kontaktdrucks in einem
linken Hüftgelenk, Typ1, Belastungsstufe 75%KG.
Abb. 4.44: Fuji-Druckmeßfolie mit Verteilungsmuster des Kontaktdrucks in einem rechten
Hüftgelenk, Typ 2, Belastungsstufe 75%KG.
Die Höhe der Kontaktdrücke lag bei einer Lasteinleitung von 25% KG zwischen minimal ca. 0,75 und maximal ca. 2,7 MPa. Bei der höchsten Belastungsstufe von 400% des Körpergewichts, haben Vorderhorn, Hinterhorn und Pfannendach des Acetabulum maximale Kontaktdrücke von ca. 8-10 MPa.
Der Kontaktdruck beträgt beispielsweise im Präparat w1 157 bei einer Lasteinleitung von 25% KG im Kaudalhorn und am Übergang von Pfannendach zum Vorderhorn ca. 0,75-1 MPa (Abb. 4.45).

Abb. 4.45: Fuji Druckmessfolie (Super low type), falschfarbene Darstellung der Höhe
der Kontaktdrücke bei einer Lasteinleitung von 25% KG bei Hund w1 157.
Bei einer Belastung von 75% KG steigt der Druck auf ca. 2,7 MPa an. Der Kontaktdruck im Vorderhorn ist niedriger und liegt bei ca. 2 MPa (Abb. 4.46).

Abb. 4.46: Fuji Druckmessfolie (Super low type), falschfarbene Darstellung der Höhe der
Kontaktdrücke bei einer Lasteinleitung von 75% KG bei Hund w1 157.
Mit steigender Belastung (bis 400% KG) nimmt der Kontaktdruck im Kaudalhorn auf über 10 MPa zu und erreicht somit den oberen Messbereich des low pressure type Films (Abb. 4.47 und Abb. 4.48). Auch bei der höchsten Belastungsstufe ist der Druck inhomogen über die Kontaktfläche verteilt. Die Hauptlast liegt auf dem Kaudalhorn.

Abb. 4.47: Fuji Druckmessfolie (Low type), falschfarbene Darstellung der Höhe der Kontaktdrücke
bei einer Lasteinleitung von 200% KG bei Hund w1 157.
Abb. 4.48: Fuji Druckmessfolie (Low type), falschfarbene Darstellung der Höhe der Kontaktdrücke
bei einer Lasteinleitung von 400% KG bei Hund w1 157.
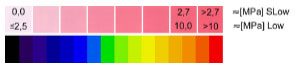
Abb. 4.49: Rottöne und zugeordnete Falschfarben.
5 Diskussion
Die Belastung des Hüftgelenks ist in vivo und in vitro schwer zu bestimmen,
ohne die Integrität des Gelenks zu verletzen. Ein neuer Ansatz biomechanischer
Studien ist daher, die Grundprinzipien der Lastübertragung im Gelenk
indirekt durch eine Analyse der funktionellen Anpassung der unmittelbar beteiligten
Strukturen – des Gelenkknorpels und der darunter liegenden subchondralen
Knochenplatte – zu bestimmen. Dies ist zulässig, da es analog Pauwels
Theorie von der kausalen Histogenese der Gewebe (1960) und gemäß dem
Wolff‘schen Gesetz der Transformation der Knochen (1892) möglich ist, von der
funktionellen Struktur eines Gewebes auf seine mechanische Langzeitbelastung
zurück zu schließen. Die Struktur der Gelenkflächen spiegelt die Summe
ihrer langfristigen Belastungen wider. Die Langzeitbelastung eines Hüftgelenks
ergibt sich aus der einwirkenden resultierenden Gelenkskraft, die sich aus der
Summe von Gewichtskraft und Muskelkräften zusammensetzt (Pauwels, 1965).
Diese wirkt je nach Stellung des Gelenks während eines Gangzyklus auf unterschiedliche
Anteile der Gelenkflächen ein (An et al., 1997).
5.1 Methodik
5.1.1 Untersuchungsgut
Die Auswahl der Tiere setzte sich aus den vorhandenen Tieren des anatomischen
Präparierkurses zusammen. Es wurden vermehrt große Rassen ausgewählt,
da diese besonders von entwicklungsbedingten Erkrankungen des Hüftgelenks
betroffen sind. Juvenile Tiere unter 2 Jahren wurden nur vereinzelt vergleichsweise
untersucht, da bei ihnen die mechanische Anpassung noch nicht
in so deutlicher Weise stattgefunden hat wie in adulten Tieren. Die Gelenkknorpelgesundheit
war das entscheidende Selektionsmerkmal für die Studie. Es
wurden keine Hüftgelenke zugelassen, die makroskopische Anzeichen von
Knorpelläsionen oder Gelenkdeformation aufwiesen. Während der Untersuchungen
wurden die Gelenkoberflächen stets feucht gehalten, da ein Austrocknen
die mechanische Kompetenz des Gelenkknorpels erheblich beeinträchtigt (vgl. Kap.2.1.4).
5.1.2 Spaltlinien
Die Spaltlinienmethode stellt eine einfach durchzuführende Untersuchungsmöglichkeit
der Ausrichtung der kollagenen Fasern in Knorpel- und Knochengewebe
dar. Es konnten gute, reproduzierbare Ergebnisse damit erzielt werden, ebenso
wie auch in Paralleluntersuchungen von Dickomeit (2002) am Ellbogengelenk
und von Eller (2003) am Schultergelenk des Hundes. Das erzeugte regelmäßige
Muster spricht für eine gleichförmige Belastung des Gelenks. Durch ein vollkommen
willkürliches Ansetzen der Nadel bei den Einstichen (vgl. Konermann,
1971) kann ausgeschlossen werden, dass die Muster bewusst produziert wurden.
Die Untersuchung der Spaltlinien am Knorpelpräparat erforderte eine schnelle Durchführung, da bei ausgetrocknetem Gelenkknorpel die Gewebespannung nachlässt und somit keine Spaltlinien mehr erzeugt werden können. Die Spaltlinienmuster sind sehr fein und nur unter der Lupe zu erkennen. Daher wurde auf eine fotografische Darstellung der Ergebnisse verzichtet.
Bei den Spaltlinien am Knochenpräparat konnte festgestellt werden, dass während des Entkalkungsvorgangs die verschiedenen Bereiche einer Gelenkfläche unterschiedlich schnell entkalken. So war es möglich, dass am Acetabulum z.B. der innere Gelenkrand schon extrem hydrolysiert war, während Einstiche in Vorder-, Hinterhorn und Pfannendach des Acetabulum nur unter relativ großer Kraftaufwendung möglich waren. Diese stärkere Mineralisierung an Vorder-, Hinterhorn und Pfannendach deckt sich gut mit den Ergebnissen der CT-OAM.
Lichtmikroskopische (Bullough und Goodfellow, 1968) und transmissionselektronenmikroskopische (Meachim et al., 1974) Untersuchungen der Tangentialfaserschicht des Gelenkknorpels bewiesen, dass Spaltlinien sich in ihrer Längsachse entlang der in der oberflächlichsten Knorpelschicht parallel zur Oberfläche verlaufenden Kollagenfasern ausrichten und dabei einer Hauptrichtung folgen. Beim Einstich werden Querverbindungen gelöst, das Gewebe reißt entlang der Kollagenfasern (Benninghoff, 1925b; Bullough und Goodfellow, 1968).
Der Kollagenfaserverlauf der subchondralen Knochenschicht entspricht in konkaven Gelenken der vorhergesagten Dehnungsspannung im Computersimulationsmodell mit der Finite Element Technik (Eckstein et al., 1999). Die Linien entstehen in der Form nur in Gewebe, das unter Dehnungsspannung steht (Eckstein et al., 1999). Dort, wo keine Dehnungsspannung vorhergesagt wurde, z.B. in den konvexen Gelenkanteilen, wurde auch keine deutliche Richtung der Spaltlinien gefunden (Eckstein et al., 1999).
Die Art der mechanischen Belastung zeigt sich in der Vorzugsrichtung der Kollagenfasern in der Tangentialfaserschicht und im subchondralen Knochen. Sie ist Ausdruck einer funktionellen Anpassung an ihre längerfristige Beanspruchung. Die Analyse der Mikrostruktur von Knorpel- und Knochengewebe stellt somit eine geeignete Möglichkeit dar, die Belastung der Gelenkflächen indirekt zu ermitteln.
5.1.3 Knochendichte
Bei allen Hüftgelenken der Studie konnte ein einheitliches Verteilungsmuster
der Knochendichte beobachtet werden. Die hohe Reproduzierbarkeit der Methode
wurde bereits an anderer Stelle gezeigt (Dickomeit, 2002). Gute Ergebnisse
konnten in früheren Untersuchungen mit dieser Methode für das Ellbogengelenk
des Hundes (Kaser, 1998; Körbel, 2000), für das Schultergelenk
(Böhmisch, 1998) und das Fesselgelenk (Böttcher et al., 1999; Maierl et al.,
2001) des Pferdes erzielt werden. Die flächenhafte Darstellung der Dichteverteilung
in Form von farbig abgestuften Dichtekarten auf der Oberfläche eines dreidimensional
rekonstruierten Gelenks mittels der CT-OAM, ermöglicht eine exakte,
schnelle und individuelle Beurteilung der Beanspruchung eines Gelenks.
Mit der radiologischen Bestimmung der Knochendichte wird nicht die physikalische Dichte wiedergegeben, sondern ein unterschiedlicher Mineralisierungsgrad. Die radiologische Dichte entspricht der Röntgenstrahlenabsorption. Der HU-Wert ist ein Maß für den linearen Schwächungskoeffizienten. Die Absorption von Röntgenstrahlung hängt von Elementen mit der höchsten Ordnungszahl in einem Gewebe ab, d.h. von den Mineralsalzen im Knochen. Es werden dabei keine absoluten Werte dargestellt, sondern relative Konzentrationsunterschiede der Dichte innerhalb einer Gelenkfläche (Müller-Gerbl et al., 1990). Daher ist es notwendig, ein Phantom mit bekannter Dichte während des Scannvorgangs zu unterlegen. Dies gestattet eine spätere Eichung der Dichtewerte der einzelnen CT-Schnittbilder auf die Referenzwerte des Phantoms zur Eliminierung von Messfehlern.
Neuere Computerprogramme ermöglichten die statistische Auswertung der individuellen Knochendichtewerte. Die quantitative Auswertung durch die Maximal Intensity Projection (MIP) in Kombination mit dem Programm VTK CISG und der Tabellenkalkulation, stellt eine erhebliche Verbesserung gegenüber früheren Untersuchungen dar, in welchen mittels eines Rasters die einzelnen „Dichtepunkte“ pro Quadrant ausgezählt wurden. Durch das VTK CISGProgramm war es möglich, die Gelenkflächen von Hüftgelenken unterschiedlicher Größe und Form (vgl. Formvarianten Kap. 2.1.1 und 2.1.2) so aneinander anzupassen, dass die entsprechenden Strukturen vergleichbar waren. Extrem unterschiedliche Krümmungen der Gelenkflächen des Hüftgelenks und die erheblichen individuellen Unterschiede der Form der kranioventralen und kaudoventralen Begrenzung der Facies lunata machten es allerdings im Einzelfall schwierig bis unmöglich, die Gelenkflächen zur Deckung zu bringen und limitierte somit die Zahl der untersuchten Hüftgelenke.
Das Dichteverteilungsmuster der Summationsbilder wurde mit den Mustern der Einzelbilder subjektiv verglichen. Sie wiesen eine gute Übereinstimmung sowohl in Lokalisation der Minima und Maxima, als auch in der Höhe der Dichtewerte auf.
Die CT-OAM ist auch am lebenden Patienten anwendbar. Sie stellt eine Möglichkeit dar, zur nicht-invasiven und wiederholten Untersuchung von Gelenken, um spezielle Fragestellungen zu beantworten oder den postoperativen Verlauf nach einer Osteotomie zu kontrollieren. Bei veränderter längerfristiger Belastung verändert sich auch das Dichteverteilungsmuster, da der Knochen ständigen Umbau- und Anpassungsvorgängen unterliegt. So konnte gezeigt werden, dass bei sportlicher Aktivität die Mineralisierungsdichte zunimmt, bei Immobilisation des Gelenks die Mineralisierung seiner Gelenkfläche abnimmt (Müller- Gerbl et al., 1993a).
5.1.4 Druckversuche
Zur Analyse der Druckübertragung im Hüftgelenk wurde eine physiologische
Gelenkstellung zu Grunde gelegt. Es wurden Größe und Richtung von R sowie
die Gliedmaßenwinkelung während der mittleren Standbeinphase des langsamen
Ganges des Hundes gewählt. Sie stellt die Phase des Ganges dar, in der
nur eine Hintergliedmaße Bodenkontakt hat, während die andere nach vorne
schwingt (Adrian et al., 1966; Allen et al., 1994). Hier trägt die Gliedmaße die
anteilige Last des Körpergewichts alleine, d. h. sie ist die Phase, die die Langzeitbelastung
des Hüftgelenks maßgeblich bestimmt.
Durch einen entsprechenden Versuchsaufbau wurde angestrebt, den Kraftvektor der Resultierenden in allen drei Dimensionen nachzuahmen. Im Gegensatz zu früheren Untersuchungen, in welchen die Gelenkenden in einem willkürlichen Winkel belastet wurden (Dickomeit, 2002), lassen sich durch die Wahl einer physiologischen Belastungssituation gezielte Aussagen zur Druckverteilung für eine Gangphase treffen.
In der Versuchsanordnung wurden die Gelenkanteile von Femur und Acetabulum dementsprechend so fixiert, dass die Richtung von R, nämlich nach kaudal, ventral und lateral, mit der Bewegungsachse des Kraftarms der Materialprüfmaschine zusammenfällt und die Gelenkanteile in den entsprechenden Winkeln artikulieren.
Die Werte, nach welchen der Versuchsaufbau erfolgte, stammten von einer in vivo Studie mittels instrumentierter Hüftendoprothesen (Page et al., 1993). Obwohl die instrumentierte Prothese einen Fremdkörper im Gelenk darstellt, kann aufgrund von Gangmusteranalysen davon ausgegangen werden, dass diese Methode exakte Werte der Höhe und Richtung der Gelenkbelastung liefert.
Im Gegensatz zu den Messungen in vivo sind die Angaben der Richtung und Größe der Gelenkreaktionskraft anhand zweidimensionaler (Arnoczky und Torzilli, 1981; Weigel und Wasserman, 1992) und dreidimensionaler Modelle (Shahar und Bank-Sills, 2001) trotz ihres interessanten Ansatzes für weiterführende Untersuchungen nicht geeignet. Zweidimensionale Berechnungen geben einen ersten Eindruck von der Größe der Kräfte, wenngleich die Richtung nur in einer Ebene angegeben werden kann. Dreidimensionale Modellberechnungen gestatten zwar Angaben über die Richtung der Kräfte im Raum, sind aber aufgrund der notwendigen mathematischen Vereinfachungen mit Fehlern behaftet.
In der Versuchsanordnung waren Os femoris und Acetabulum relativ starr fixiert. Dies steht im Gegensatz zur Situation in situ, in der der Belastung entsprechende Muskelkräfte entgegenwirken. Es war jedoch eine akzeptable Vereinfachung für den Versuchsaufbau, da sich das Becken erst bei höheren Belastungen geringfügig verformt (Eckstein et al., 1997d; Eisenhart-Rothe et al., 1996; Eisenhart-Rothe et al., 1999). Untersuchungen in der Humanmedizin zur Druckverteilung im Hüftgelenk unter Simulation der Muskelzüge am Becken ergaben keine auffällig anderen Ergebnisse als in Studien, die eine Fixierung an der Symphyse durchführten (Eisenhart-Rothe et al., 1999).
Die Größe der eingeleiteten Kraft wurde relativ zum Körpergewicht des Tieres gewählt, so dass unterschiedlich große Absolutwerte zur Anwendung kamen. Nach ganganalytischen Untersuchungen beträgt die Kraft, die in der mittleren Standbeinphase im langsamen Schritt auf das Hüftgelenk wirkt das 0,5- 1,65fache des Körpergewichts (Bergmann et al., 1984; Page et al., 1993). Nach der Schätzung von Prieur (1980) ist das Hüftgelenk während normaler Aktionen wie Galopp und Springen Belastungen ausgesetzt, die bis zum 4fachen des KG entsprechen können. Daher wurden in der vorliegenden Studie für die eingeleitete Kraft neun Belastungsstufen vom 0,25fachen KG bis zum maximal 4fachen des KG gewählt.
5.1.4.1 Abdruckmassen
Gelenkabdrücke unter verschiedenen Belastungen geben Auskunft über die
Kontaktflächen, Gelenkspaltweite und ihre Änderungen in Abhängigkeit von der
Belastung des Gelenks.
Die in der vorliegenden Untersuchung verwendete Silikonabdruckmasse hat den Vorteil, dass sie gut formbar ist und bereits bei geringer Belastung leicht aus dem Gelenkspalt verdrängt wird. Es wurde vermutet, dass Abdruckmaterial die tatsächliche Größe der Kontaktflächen unterschätzt, wenn die Massen den Gelenkspalt nicht gut verlassen können (Ateshian et al., 1994). Daher wurde während der Studie darauf geachtet, dass das Material gut durch die Inc. acetabuli ausgedrückt werden konnte. Das Material härtet in relativ kurzer Zeit aus, so dass Gelenkverformungen durch statische Dauerbelastung des Knorpels ausgeschlossen werden konnten. Die Silikonmasse stammt aus der Zahnmedizin und ist daher gut geeignet, exakte Abdrücke zu liefern. Dies konnte durch die Ermittlung des Varationskoeffizienten von 5% bestätigt werden. Die Aussagekraft von Abdruckmassen wurde auch an menschlichen Gelenken bestätigt (Eisenhart-Rothe et al., 1996; Eisenhart-Rothe et al., 1997).
5.1.4.2 Fuji Druckmessfolie
In dieser Arbeit wurde neben den Abformmassen auch druckempfindlicher Film
verwendet, um die druckübertragenden Stellen zu ermitteln. Der Fuji Film beeinträchtigt
mit einer geringen Dicke bis zu 200 μm nur geringfügig die geometrischen
Verhältnisse im Gelenk. Der Einfluss auf die Verteilung des Drucks ist
vernachlässigbar (Afoke et al., 1987). Durch den individuellen Zuschnitt der
Filmfolien mittels Schablonen und Entlastungsschnitte wurde vermieden, dass
sich artifizielle Druckspitzen durch Falten oder Überlagerungen bildeten.
Der Messung der intraartikulären Druckübertragung mit Fuji Druckmessfolie stehen andere Methoden gegenüber, wie z.B. die Messung mit Abformmassen (siehe oben), Färbemethoden (Goodfellow und Mitsou, 1977) oder die Stereophotogrammetrie (Ateshian et al., 1994). Während bei diesen Methoden allerdings nur die druckübertragenden Flächen ermittelt werden, liegt der Vorteil der Messung des Drucks mittels drucksensitiven Films darin, zusätzlich die Verteilung des Drucks sowie dessen Höhe durch eine unterschiedliche druckproportionale Färbung des Films quantitativ zu ermitteln.
5.2 Ergebnisse
5.2.1 Spaltlinien
Durch die Verteilung des Drucks während der Belastung auf der Gelenkfläche
entstehen verschiedene Bereiche, in denen sich die kollagenen Fasern je nach
Beanspruchung im Sinne eines „verkörperten Spannungsfeldes“ ausrichten
(Pauwels, 1960).
In der vorliegenden Studie wurde an gesunden Hüftgelenken ein konstantes Verteilungsmuster der Knorpelspaltlinien und Spaltlinien der subchondralen Knochenplatte unabhängig von Rasse, Alter oder Geschlecht gefunden. Untersuchungen an einzelnen Gelenken mit Knorpelschäden zeigten, dass Knorpelläsionen keinen Einfluss auf das Spaltlinienmuster haben.
Das Verteilungsmuster der Knorpelspaltlinien auf der Facies lunata wies auf eine Druckbelastung im Vorder- und Hinterhorn sowie im kraniolateralen Bereich hin. Hier fanden sich wirbelförmige bzw. zirkuläre Anordnungen der Spaltlinien. An der subchondralen Knochenplatte fanden sich ebenso im kranio- und kaudoventralen Bereich Hinweise auf eine Druckbeanspruchung. Die Spaltlinien ordneten sich hier radiär an. Dies kann auf eine Biegung der seitlich überstehenden Anteile bei Druckbelastung der gelenksrandnahen Bereiche zurückgeführt werden (Schön et al., 1998).
Die Artikulationsfläche des Caput ossis femoris wird auf der kraniomedialen und kaudolateralen Fläche auf Druck beansprucht. Hier finden sich zirkulär angeordnete Spaltlinien des Gelenkknorpels. Im Gegensatz dazu war kein Spaltlinienmuster im subchondralen Knochen erzeugbar. Dies war auch nicht zu erwarten, da an konvexen Gelenkflächen keine Dehnungsbeanspruchung auftritt. Das Caput ossis femoris ist als konvexer Gelenkkörper gegenüber einer Biegebeanspruchung relativ gut abgestützt. Daher lassen sich hier auch nur vereinzelt Gewebespalten darstellen, da die Belastung fast ausschließlich eine Druckbelastung ist.
Dies ist durch das unterschiedliche Verhalten von Kollagenfasern unter Druckund Zugbelastung zu erklären. Unter reiner Druckbelastung werden die sich überkreuzenden Kollagenfasern durch eine Querdehnung gleichförmig in alle Richtungen beansprucht. Es sind nur punkt- oder sternförmige Spaltlinien produzierbar (Abb. 5.1). Bei inkongruenten Gelenken mit tiefer Gelenkpfanne, die unter einer Druckbelastung eine Aufdehnung erfährt, entsteht zwischen den Kontaktpunkten eine Dehnungsspannung im Gewebe. Diese führt zu einer Vorzugsrichtung der Kollagenfasern in Richtung der Dehnungsspannung (Abb. 5.2).
Abb. 5.1: Anordnung der sich überkreuzenden Kollagenfasern der Tangentialfaserschicht des
Gelenkknorpels unter reiner Druckbelastung; es bilden sich keine Spalten aus, sondern die Einstiche bleiben punktförmig.
Abb. 5.2: Anordnung der sich überkreuzenden Kollagenfasern der Tangentialfaserschicht des
Gelenkknorpels unter Zugbelastung; es bilden sich Spalten aus, die der Vorzugsrichtung der Kollagenfasern entsprechen,
die Spaltlinien repräsentieren den „Summenvektor“ der Kollagenfaserausrichtung.
Das unterschiedliche Muster von Knochen- und Knorpelspaltlinien lässt sich auf die unterschiedliche hohe Deformierbarkeit der beiden Gewebe zurückführen.
Die Ergebnisse der Spaltlinienuntersuchung können dahingehend interpretiert werden, dass im Acetabulum eine Dehnungsspannung in kraniokaudaler Richtung im Gelenk vorhanden ist. Die Druckübertragung findet vermehrt zwischen den Artikulationsflächen an der gelenksrandnahen Kranial- und Kaudalfläche des Gelenks statt und nicht wie man annehmen könnte, über den dorsalen Teil des Femurkopfes und das Pfannendach. Spaltlinien am Knochensteg unterhalb des Lig. transversum acetabuli und in der Fossa acetabuli entlang einer kraniokaudalen Richtung lassen auch hier erhebliche Dehnungsspannung in Richtung des Längendurchmessers des Acetabulum vermuten. Dies lässt auf eine Aufspreizung des halbkugelförmig gebogenen Acetabulum unter Belastung schließen.
Die mit der Spaltlinienmethode als druckbelastet identifizierten Stellen der Gelenkfläche stimmen mit den druckübertragenden Flächen, die mittels Fuji Druckmessfolie ermittelt wurden überein. Sie entsprechen auch den Stellen, an welchen die subchondrale Knochenplatte stärker mineralisiert ist (vgl. 5.2.2). Darüber hinaus sind diese attraktiven singulären Punkte deckungsgleich mit Stellen arthrotischer Knorpelveränderungen.
Repulsive singuläre Punkte sind deckungsgleich mit faserknorpeligen Erweichungen, die vor allem am ventromedialen Rand der Facies lunata am Übergang zur breitesten Stelle des Acetabulum vorkommen. Hier divergieren die Knorpelspaltlinien in zwei verschiedene Richtungen (repulsiver singulärer Punkt). Diese Punkte repräsentieren Orte geringen Drucks. Auch wenn keine makroskopischen Läsionen sichtbar waren, ließen sich in einigen Gelenken in diesem Bereich keine Spaltlinien erzeugen. Durch die fehlende Druckbelastung ist der Knorpelerhaltungsreiz gering und der Gelenkknorpel erfährt nicht die „Walkung“, die für die Ernährung und Durchsaftung des Gelenkknorpels notwendig ist. Da der Druck für den Knorpelerhaltungsreiz hier unter die Minimalgrenze fällt, wird der Gelenkknorpel dünn und eine funktionelle Anpassung an eine mechanische Beanspruchung unterbleibt (Pauwels, 1959). Das Ergebnis der Druckflächenbestimmung mittels drucksensitiven Films bestätigte, dass hier allenfalls unter sehr hoher Belastung (400% KG) eine Druckbelastung auftritt.
Für das menschliche Hüftgelenk konnte ähnliches gezeigt werden (Molzberger, 1973; Tillmann, 1969; Tillmann, 1978a). Die Muster der Spaltlinien legen nahe, dass es innerhalb einer Gelenkfläche Orte mit unterschiedlicher Beanspruchung gibt. Wird dabei eine gewisse Toleranzgrenze überschritten, „so ist zu erwarten, dass Zerstörungen des Gelenkknorpels zuerst da einsetzen, wo a priori schon eine höhere Beanspruchung vorhanden ist“ (Tillmann, 1978b). Der Übergang zu pathologischen Veränderungen an der Gelenkfläche ist fließend und stellt ein rein quantitatives Problem dar (Tillmann, 1973).
Vogt et al. (1999b) untersuchten die subchondralen Spaltlinien an menschlichen Hüft- und Schultergelenkspräparaten und konnten ebenso eine Zugspannung für diese beiden Gelenke indirekt über das Spaltlinienmuster nachweisen. An den Gelenkflächen der konvexen Gelenkpartner ließen sich, wie auch schon bei Schön et al. (1998), keine Hauptverlaufsrichtungen der Spalten darstellen (Vogt et al., 1999a; Vogt et al., 1999b). An den konkaven Gelenkpartnern wurde jedoch eine einheitliche Hauptverlaufsrichtung, die der des Hundes gleicht, beobachtet. Dies wird erklärt durch eine überwiegende Druckübertragung über die peripheren Anteile der Facies lunata (Afoke et al., 1987; Eisenhart-Rothe et al., 1997; Eisenhart-Rothe et al., 1999), die dazu führt, dass das Acetabulum während der Belastung aufgebogen wird. Untersuchungen zur Dehnung des Lig. transversum acetabuli untermauerten dies zusätzlich (Löhe et al., 1996).
5.2.2 Knochendichte
In der vorliegenden Studie konnte gezeigt werden, dass die Knochendichte inhomogen
im Hüftgelenk verteilt ist. Die ermittelten Dichtemuster spiegeln die
längerfristige Beanspruchungsverteilung in Gelenkflächen wider. Die bizentrische
Verteilung der Dichtemaxima an den ventralen Gelenkflächen von Acetabulum
und Femurkopf deuten darauf hin, dass die Druckverteilung im Gelenk
unter Belastung nicht gleichförmig über die Gelenkoberfläche stattfindet, wie
das in kongruenten Gelenken zu erwarten wäre. Vielmehr werden die peripheren
Gelenkanteile stärker beansprucht als die laterodorsalen (Caput ossis femoris)
bzw. medioventralen Bereiche (Facies lunata). Die Ergebnisse aus den
Druckversuchen untermauern diese Behauptung. Die Kontaktflächen bzw.
Druckmaxima sind deckungsgleich mit den Orten einer hohen subchondralen
Knochendichte. Das Spaltlinienmuster des Gelenkknorpels zeigt ebenfalls an
diesen Stellen eine Druckbelastung an.
Das dritte Maximum im Pfannendach lässt sich allerdings nicht durch eine Druckbeanspruchung erklären, sondern vielmehr durch eine Dehnungsspannung. Unter Belastung wird die tiefe konkave Pfanne des Hüftgelenks durch den Femurkopf aufgedehnt. Die hohe Mineralisierungsdichte des Knochenstegs, der die mediale Begrenzung der Inc. acetabuli bildet, weist gleichfalls auf eine vorhandene Dehnungsspannung im Gelenk hin.
Dementsprechend wäre das Knochendichtemaximum im Bereich der Fovea capitis des Oberschenkelkopfs mit einer Zugbeanspruchung durch den Ansatz des Lig. capitis ossis femoris zu erklären. Dies würde für eine bremsende Funktion des Femurkopfbandes unter extremen Bewegungen sprechen (vgl. Henschel, 1983). Es wäre allerdings auch möglich, dass das Dichtemaximum durch eine Druckbeanspruchung an dieser Stelle hervorgerufen wird, wie es bei einer stoßbrechenden Funktion des Femurkopfbandes denkbar wäre (vgl. Köppel, 1991). Im Rahmen dieser Untersuchung war es jedoch nicht möglich, zwischen diesen beiden Theorien zu differenzieren. Die Funktion des Lig. capitis femoris bleibt weiterhin ungeklärt.
Die ermittelten Knochendichtewerte im Acetabulum stimmen sehr gut mit den Befunden von Oberländer (1973) und Müller-Gerbl et al. (1993c) am menschlichen Acetabulum überein. Auch sie fanden eine größere Knochendichte am Rand der Facies lunata und im Bereich der Inc. acetabuli, die zum inneren Gelenkrand und zur Fossa acetabuli hin abfällt. Ebenso wie beim jungen Hund ist auch beim jugendlichen Menschen eine insgesamt geringere Knochendichte, vor allem am Pfannendach, ausgebildet. Das bizentrische Verteilungsmuster deckt sich gut mit den Ergebnissen von Tillmann (1978a) und Müller-Gerbl und Putz (1993).
Nach den Theorien über die funktionelle Anpassung der Stützgewebe an ihre jeweilige mechanische Langzeitbelastung (Kummer, 1962; Pauwels, 1965; Pauwels, 1980; Wolff, 1892) wird neben der Ultrastruktur auch die Knochendichte durch die mechanische Beanspruchung modelliert. Allerdings hat Pauwels die Dichte der subchondralen Knochenplatte in Form eines „verkörperten Spannungsfeldes“ als Ausdruck einer Druckbeanspruchung verstanden und daher als direktes Maß für die Langzeitbelastung der Gelenkfläche angesehen (Pauwels, 1965; Pauwels, 1980). In früheren Untersuchungen wurde davon ausgegangen, dass die Knochendichteverteilung die längerfristige Druckverteilung an der Gelenkfläche widerspiegelt (Eckstein et al., 1992; Eckstein et al., 1994a; Eckstein et al., 1995c; Müller-Gerbl et al., 1989; Müller-Gerbl et al., 1992; Oberländer, 1973; Tillmann, 1978a).
Diese Theorie konnte von Eckstein für Gelenke mit tiefen Pfannen durch neuere Untersuchungen mittels der FEM (Eckstein et al., 1997c; Eckstein et al., 1999; Jacobs und Eckstein, 1997) und einer kritischen Betrachtung von Kontaktflächen, Kontaktdruck und subchondraler Knochendichteverteilung (Eisenhart- Rothe et al., 1997) nur teilweise bestätigt werden. Nicht nur Druck, sondern auch Spannung und Biegung bestimmen die Modellierung des Knochens. An inkongruenten Gelenkflächen spielt besonders in den konkaven Gelenkanteilen neben der Druckspannung auch eine Dehnungsspannung eine Rolle als formativer Reiz.
Die Verhältnisse am subchondralen Knochen in der Tiefe der Pfanne weichen in einem inkongruenten Gelenk von der Druckbelastung auf der Gelenkfläche ab. So ist im Pfannendach ein Knochendichtemaximum zu finden, obwohl hier im inkongruenten Gelenk keine ständige Flächenpressung stattfindet. Es ist entgegensetzt früherer Annahmen im inkongruenten Gelenk nicht möglich, über das Verteilungsmuster der Knochendichte eine direkte Analyse der längerfristigen Druckübertragung zu betreiben (Eckstein et al., 1999; Jacobs und Eckstein, 1997). Somit kann die Spannungsverteilung auf der Gelenkfläche erheblich von der Beanspruchungsverteilung am subchondralen Knochen abweichen (Schön et al., 1998).
5.2.2.1 Ergebnisse in Abhängigkeit vom Alter
Die Gegenüberstellung der Summationsbilder von Hunden verschiedener Altersgruppen
in der vorliegenden Studie ergab eine altersabhängige Zunahme
der relativen Knochendichte im kaninen Hüftgelenk. Die Bereiche maximaler
Dichte dehnen sich dabei bei älteren adulten Hunden (+8 Jahre) aus und verlagern
sich in Richtung auf das Pfannendach.
Diese Ergebnisse befinden sich in Übereinstimmung mit den Ergebnissen für das menschliche Hüftgelenk, die unterschiedliche Dichtemuster für junge und alte Menschen fanden. Dies wurde auf einen unterschiedlichen Inkongruenzgrad zurückgeführt (Müller-Gerbl, 1993). Bullough et al. (1968) zeigten für das menschliche Hüftgelenk, dass sich die Geometrie des Gelenks mit dem Alter ändert, im Besonderen, dass die Gelenkflächen zunehmend kongruenter werden. Das wird auch durch eine Änderung des zweigipfeligen Verteilungsmusters der subchondralen Knochendichte an der menschlichen Facies lunata zu einem monozentrisch zentral lokalisierten Dichtemaximum begleitet (Müller-Gerbl et al., 1993c). Badoux und Hoogeveen (1976) stellten für das kanine Hüftgelenk eine ähnliche Abnahme des Inkongruenzgrades vom jugendlichen zum adulten Hund fest. Die Dichtemuster am kaninen Hüftgelenk zeigen jedoch keine dermaßen deutliche Verschmelzung der Dichtemaxima zu einem einzigen zentralen Dichtemaximum. Die altersabhängige Inkongruenz von Gelenken muss bei der Erarbeitung von Therapiekonzepten gegebenenfalls berücksichtigt werden (Müller-Gerbl, 1993).
5.2.2.2 Einfluss des Antetorsionswinkels auf die Knochendichteverteilung
Veränderungen der Winkel am proximalen Femurende, wie z.B. des Hals-
Schaft-Winkels, des Antetorsionswinkels oder die Subluxation der Hüfte stellen
eine Veränderung der Hebelarme dar und haben daher Einfluss auf die Beanspruchung
der Gelenkoberflächen im Hüftgelenk.
Die gemessen Torsionswerte dieser Studie bewegen sich am unteren Rand der von Löer (1999) angegebenen Werte, bzw. sind kleiner als diese Werte. Der dort angegebene ATW liegt bei durchschnittlich 33,8° (19-50°) für große Rassen und bei durchschnittlich 33,2° (17-49°) für kleine Rassen. In der vorliegenden Studie wurde für große Rassen ein Mittelwert von 19° und für kleine Rassen ein Mittelwert von 10,5° ermittelt.
Es konnte ein Zusammenhang zwischen einem verkleinerten ATW (< 15°) und einem typisch veränderten, nach medial verschobenen, Verteilungsmuster der Dichtemaxima am Caput ossis femoris festgestellt werden. Die Knochendichte tendiert bei kleinen ATW zu einem monozentrisch gelegenen Dichtemaximum im medialen Gelenkanteil. Die kraniale Gelenkfläche weist, im Gegensatz zu den Hunden mit einem ATW innerhalb der Normgrenzen, kein deutliches Dichtemaximum auf. Die Fovea capitis und ihre Umgebung sind hoch mineralisiert. Die kaudale Gelenkfläche besitzt ein deutlich zweigeteiltes Dichtemaximum. Diese Ergebnisse lassen vermuten, dass ein verkleinerter Antetorsionswinkel die Belastungssituation im Gelenk langfristig dahin gehend ändert, dass die Gelenkfläche des Os femoris ungleichmäßiger belastet wird. Der kraniale und kaudale Anteil wird entlastet, dafür wird der mediale Bereich stärker belastet. Allerdings war die Anzahl der Hunde (n=8), die dieses typische Bild zeigten, zu gering, um eine gesicherte Aussage treffen zu können.
5.2.3 Kontaktflächen und Kontaktdrücke
Für die Beanspruchung eines Gelenks sind die an der Gelenkfläche auftretenden
Spannungen verantwortlich (Pauwels, 1961). Die Untersuchungen zeigten,
dass bei geringen Belastungen die Last peripher an der Gelenkfläche übertragen
wird. Bei höherer Belastung vergrößern sich die druckübertragenden Stellen
in Richtung Zentrum sowie Kranial- und Kaudalhorn. Mit einer weiteren
Steigerung der Last konfluieren sie schließlich. Dabei behalten sie jedoch ihre
Maxima an Kranial- und Kaudalhorn.
Die Ergebnisse bestätigen, dass bei der Lastübertragung im Gelenk der Druck nicht einheitlich, sondern inhomogen über die Gelenkoberfläche verteilt ist. Die trizentrische Druckübertragung nimmt mit zunehmender Belastung ab. Durch die Deformation des Knorpels und der subchondralen Knochenplatte wird eine Gelenkgeometrie erreicht, in der die Belastung über vergrößerte Kontaktflächen verteilt wird (Eckstein et al., 1994a). Die Studie mit drucksensitivem Film zeigte jedoch, dass das Druckmaximum immer noch in Vorder- und Hinterhorn liegt, selbst wenn ein Status der Kongruenz erreicht wird. Dies stimmt mit Ergebnissen für menschliche Gelenkflächen überein (Afoke et al., 1987; Eisenhart-Rothe et al., 1996; Eisenhart-Rothe et al., 1997).
Die Orte, die Druckmaxima in der Filmstudie aufweisen, sind dieselben Stellen, die am häufigsten Knorpelusuren zeigen.
Die Studie mit Abformmasse zeigt, dass ein Gelenkspalt im inkongruenten Hüftgelenk auch während der Belastung bestehen bleibt. Er ist bei den Individuen unterschiedlich groß und verringert sich mit zunehmender Belastung. Die Beanspruchung im Hüftgelenk kann so verstanden werden, dass unter leichten Belastungen hauptsächlich der Rand des Acetabulum mit der korrespondierenden Fläche des Femurkopfes artikuliert, mit steigender Belastung der Femurkopf tiefer in das Acetabulum gedrückt wird und dieses aufbiegt. Dadurch wird eine initial kleine Kontaktfläche einheitlich vergrößert und der Druck auf einen größeren Anteil der Gelenkfläche verteilt, indem eine sekundäre Kongruenz erreicht wird. Das Pfannendach kann als ein Bereich betrachtet werden, der nur bei größerer Belastung Kontakt hat.
5.2.4 Pathologische Veränderungen Die Befunde der vorliegenden Studie zum Vorkommen der pathologischen Veränderungen im Hüftgelenk befinden sich in Übereinstimmung mit den morphologischen und biomechanischen Parametern. Die Stellen besonders häufig lokalisierter degenerativer Knorpelläsionen sind deckungsgleich mit den Stellen, für welche mittels der Spaltlinienmethode, der CT-OAM und der Untersuchung mit Fuji Druckmessfolie eine Druckbelastung angezeigt wurde.
5.3 Schlussfolgerung
Die Ergebnisse der vorliegenden Untersuchungen zeigen, dass es sich beim
gesunden Hüftgelenk des Hundes um ein physiologisch inkongruentes Gelenk
handelt.
Es konnte im konkaven Acetabulum keine exakte Korrelation zwischen der Verteilung der besonders belasteten Kontaktflächen im Gelenk und der topographischen Verteilung der subchondralen Knochendichte ermittelt werden. Daher wurde vermutet, dass das Verteilungsmuster der subchondralen Knochendichte nicht alleine durch die Druckbelastung im Gelenk erklärt werden kann, sondern auch durch eine vorherrschende Dehnungsspannung. Die Aussagen über die Dehnungsspannungsverteilung und damit über die Beanspruchung der einzelnen Abschnitte innerhalb einer Gelenkfläche lassen sich vor allem mit Hilfe des subchondralen Spaltlinienmusters morphologisch untermauern.
Unter Belastung findet eine Lastübertragung vor allem peripher am Gelenkrand der konkaven Gelenkfläche statt. Der Femurkopf fügt sich nicht passgenau in die Pfanne ein, sondern dehnt sie vielmehr unter steigender Belastung vermehrt auf. Dieses Aufspreizen der Gelenkpfanne führt zu Dehnungsspannungen im Gelenkknorpel und subchondralen Knochen. Erst bei großen Belastungen wird auch das Pfannendach belastet. Der Zusammenhang von Kontaktflächen, Anpresskraft, subchondraler Knochendichteverteilung und Spaltlinien bestätigt dieses Prinzip (Abb. 5.3).
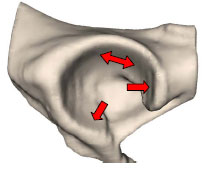
Abb. 5.3: Schematische Darstellung des Aufbiegens des Acetabulum unter Belastung.
Das Prinzip der physiologischen Inkongruenz von Gelenken mit tiefen Pfannen gewährleistet, dass die Belastung mit zunehmender Höhe auf tiefere Strukturen des Knochens gleichmäßig verteilt wird. Druckspitzen werden so vermieden und es wird garantiert, dass alle Gebiete der Gelenkfläche intermittierend belastet werden. Dies ist zum einen für die Knorpelernährung, zum anderen für die Knorpelerhaltung notwendig, die nur unter intermittierender Druckbelastung (Pauwels, 1959) erfolgt. Die Beanspruchung des Gelenks bleibt insgesamt geringer (Eckstein et al., 1994b).
Ganz im Gegensatz zur Humanmedizin hat sich der Begriff der physiologischen Inkongruenz in der Tiermedizin noch nicht etabliert. Die Kongruenz des Hüftgelenks ist bisher die Lehrbuchmeinung und wird als Grundvoraussetzung betrachtet für wissenschaftliche Untersuchungen sowie für die klinische Beurteilung.
Ausblick
Die Ergebnisse dieser Arbeit führen neben einem besseren Verständnis für die
physiologische Funktion des Hüftgelenks zu einer soliden Datengrundlage für
weiterführende Untersuchungen, wie z.B. die Modellierung von wirklichkeitsgetreuen
Computermodellen der Finite Element Technik. Die Bedeutung dieser
Methode liegt darin, dass sie ohne Eingriff am Gelenk selbst Aussagen über
das dynamische Belastungsmuster innerhalb eines Gelenkes erlaubt. Dadurch
können für die Entwicklung von Operationsmethoden und belastungsfähigeren
Prothesen exaktere Daten über die Belastungsverhältnisse im Hüftgelenk des
Hundes schneller und einfacher gewonnen werden.
6 Zusammenfassung
Erstmals wurden morphologische und biomechanische Parameter des kaninen
Hüftgelenks zur Ermittlung der langfristigen Beanspruchung der Gelenkflächen
quantitativ bestimmt. Dazu wurden 86 Hüftgelenke von 43 Hunden vorwiegend
großer Rassen (durchschnittliches Alter 6 Jahre) untersucht.
Die Dichte der subchondralen Knochenplatte wurde unter Anwendung der CTOsteoabsorptiometrie (CT-OAM) qualitativ und quantitativ ermittelt und die Dichteverteilung anhand von digitalen dreidimensionalen Gelenkrekonstruktionen in Falschfarben exakt topografisch dargestellt. Die Knochendichteverteilung zeigte regelmäßig ein trizentrisches Verteilungsmuster mit Knochendichtemaxima an den kranialen und kaudalen Gelenkflächen sowie im Pfannendach des Acetabulum und im fovealen Bereich des Caput ossis femoris. Die Torsion des Os femoris wurde mittels der computertomographischen Methode errechnet. Die Befunde ließen einen Zusammenhang zwischen einem verkleinerten Antetorsionswinkel und einer Verschiebung der Knochendichtemaxima am Caput ossis femoris nach medial vermuten.
Mittels der Spaltlinienmethode wurde die Hauptverlaufsrichtung der Kollagenfasern in der Tangentialfaserschicht des Gelenkknorpels und der subchondralen Knochenplatte untersucht. Die Spaltlinienmuster wiesen eine vorhandene Dehnungsspannung im Acetabulum nach. Daneben konnten vorwiegend druckbelastete Stellen aufgezeigt werden (Kranial- und Kaudalfläche der Facies lunata und Caput ossis femoris).
Biomechanische Parameter wie die Kontaktflächen sowie die Verteilung und Höhe des Gelenkdrucks wurden experimentell unter physiologischen Belastungsbedingungen in der mittleren Standbeinphase des langsamen Schritts mithilfe von Abformmassen und drucksensitivem Film ermittelt. Die Kontaktflächen waren bei physiologischer Gelenkstellung und geringer Belastung vor allem am peripheren Gelenkrand der Kranial- und Kaudalfläche von Facies lunata und Caput ossis femoris lokalisiert. Am kranialen Pfannendach blieb ein Gelenkspalt bis zu einer Belastung von 75% des Körpergewichts vorhanden. Unter steigender Belastung dehnten sich die Kontaktflächen in Richtung Gelenkzentrum aus.
Die maximalen Kontaktdrücke bewegten sich bei einer Belastung bis 400% des Körpergewichts zwischen 8-10 MPa. Die lastübertragenden Stellen wiesen ein deutlicher ausgeprägtes bi- oder trizentrisches Muster auf als die Kontaktflächen. Mit zunehmendem Druck verschmolzen sie zu einer einheitlichen Fläche.
Die Ergebnisse der vorliegenden Studie verdeutlichen, dass die Gelenkflächen des Hüftgelenks inhomogen belastet werden. Es konnte erstmals gezeigt werden, dass das kanine Hüftgelenk nicht, wie bisher angenommen, kongruent ist, sondern eine physiologische Inkongruenz aufweist. Diese garantiert eine optimale Lastverteilung und Ernährung des Gelenkknorpels. Darüber hinaus konnte gezeigt werden, dass degenerative Knorpelveränderungen im Sinne einer Osteoarthrose bevorzugt an Orten der inhomogen belasteten Gelenkoberfläche auftreten, die a priori einer höheren mechanischen Beanspruchung ausgesetzt sind.
7 Summary
Morphological and biomechanical characteristics of the canine hip joint
(articulatio coxae)
Morphological and biomechanical parameters of the canine hip joint have been investigated for the first time in order to determine the long term loading of the hip joint surfaces. 86 hip joints of 43 predominantly large breed dogs (average age 6 years) were examined.
By means of CT-osteoabsorptiometry (CT-OAM) the subchondral bone density was determined qualitatively and quantitatively. The exact topographic distribution of the subchondral bone density was shown in three-dimensional reconstructions of the hip joints in false colour code. The distribution pattern was regularly tricentric with bone density maxima located in the cranial and caudal aspects of the joint surfaces as well as in the roof of the acetabulum and the perifoveal area of the caput ossis femoris. The anteversion of the Os femoris was determined by a computed tomographical method. The findings allowed the assumption of a causal relationship between a reduced anteversion angle and a shift of the density maxima to the medial part of the joint surface of the caput ossis femoris.
The main direction of the collagen fibres in the joint cartilage and the subchondral bone were traced by means of the split line method. The split line pattern established proof of an existing tension and bending in the acetabulum. Moreover it identified areas of compressive stress on the surface of the joint (cranial and caudal aspect of the lunate surface and the femoral head).
Biomechanical parameters such as contact areas as well as distribution and amount of pressure were determined experimentally under physiological load conditions representing the three leg stance during slow walking. These data were gained by casting material and pressure sensitive film. At low loads and physiological angulation contact areas were mainly found at the peripheral margin of the cranial and caudal part of the facies lunata and caput ossis femoris.
At the cranial roof of the acetabulum a joint space was evident in the loaded specimens up to 75% body weight. Under increasing loads the contact areas expanded towards the joint centre.
The maximal contact pressure ranged from 8 to10 MPa under a load of 400% body weight. Areas of load transfer showed a more obvious bi- and tricentric distribution pattern than contact areas. With increasing loads areas of load transfer expanded to a uniform area.
The results of this study established proof of the inhomogeneous load distribution in the canine hip joint. For the first time it was shown that the canine hip joint is not congruous as commonly assumed but maintains a physiological incongruity. This guarantees for an optimal load distribution in the joint and for a better nutrition of the joint cartilage. Further, it was shown that osteoarthrosis more often exists in those areas of inhomogeneously loaded joint surfaces which are exposed to larger mechanical stress a priori.
8 Anhang
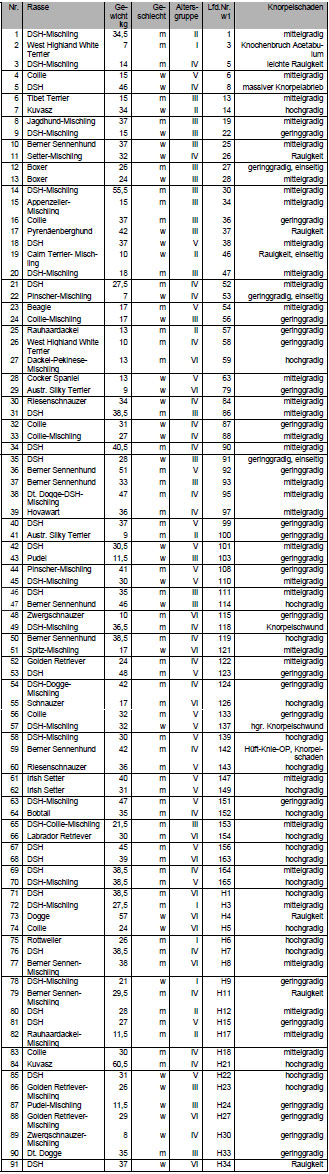
Tab. 8.1: Hunde mit Knorpelschäden
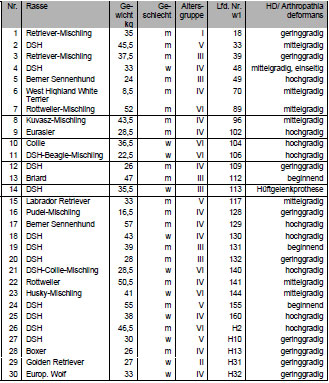
Tab. 8.2: Hunde mit HD und Arthropathia deformans

Tab. 8.3: Hunde, deren Knochendichtewerte des Acetabulum für die Erstellung eines Summationsbildes herangezogen wurden

Tab. 8.4: Hunde, deren Knochendichtewerte des Caput ossis femoris für die Erstellung eines Summationsbildes herangezogen wurden
9 Literaturverzeichnis
- Adrian, M. J., Roy, W. E. und Karpovich, P. V. (1966): Normal gait of the dog: An electrogoniometric study. Am J Vet Res 27, 90-95.
- Afoke, N. Y. P., Byers, P. D. und Hutton, W. C. (1980): The incongruous hip joint - a casting study. J Bone Joint Surg Br 62 (4), 511-514.
- Afoke, N. Y. P., Byers, P. D. und Hutton, W. C. (1987): Contact pressures in the human hip joint. J Bone Joint Surg Br 69, 536-541.
- Alexander, J. W. (1992): The pathogenesis of canine hip dysplasia. Vet Clin North Am Small Anim Pract 22 (3), 503-511.
- Allen, K., DeCamp, C. E., Braden, T. D. und Bahns, M. (1994): Kinematic gait analysis of the trot in healthy mixed breed dogs. Vet Comp Orthop Traumatol 7, 148- 153.
- Arnoczky, S. P. und Torzilli, P. A. (1981): Biomechanical analysis of forces acting about the canine hip. Am J Vet Res 42 (9), 1581-1585.
- Arnold, G., Gross, F. und Fessel, H. (1978): "In-vitro"-Versuche zum mechanischen Verhalten des hyalinen Knorpels unter statischen und dynamischen Belastungen. Z Orthop 116, 428-429.
- Arokoski, J. P. A., Hyttinen, M. M., Helminen, H. J. und Jurvelin, J. S. (1999): Biomechanical and stuctural characteristics of canine femoral and tibial cartilage. J Biomed Mat Res 48 (2), 99-107.
- Ateshian, G. A., Kwak, S. D., Soslowsky, L. J. und Mow, V. C. (1994): A stereophotogrammetric method for determining in situ contact areas in diarthrodial joints, and a comparison with other methods. J Biomech 27 (1), 111-124.
- Athanasiou, K. A., Agarwal, A., Muffoletto, A., Dzida, F. J., Constantinides, G. und Clem, M. (1995): Biomechanical properties of hip cartilage in experimental animal models [published erratum appears in Clin Orthop 1995 Nov;(320):283]. Clin Orthop 316, 254-266.
- Badoux, D. M. und Hoogeveen, P. (1976): Some notes on the biomechanics of the normal and dysplastic canine acetabulum, Proceedings of the Koninklijke Nederlandse Akademie van Wetenschappen, C.
- Bardet, J. F., Rudy, R. L. und Hohn, R. B. (1983): Measurement of femoral torsion in dogs using a biplanar method. Vet Surg 12 (1), 1-6.
- Bartel, D. L., Dueland, R. T. und Quentin, J. A. (1975): Biomechanical considerations in the design of a canine total hip prosthesis. J Am Anim Hosp Assoc 11, 553-559.
- Benninghoff, A. (1925a): Spaltlinien am Knochen, eine Methode zur Ermittlung der Architektur platter Knochen. Anat Anz (Erg H) 60, 189-205.
- Benninghoff, A. (1925b): Form und Bau der Gelenkknorpel in ihren Beziehungen zur Funktion. Zweiter Teil: Der Aufbau des Gelenkknorpels in seinen Beziehungen zur Funktion. Z Zellforsch 2, 783-861.
- Benninghoff, A. (1925c): Form und Bau der Gelenkknorpel in ihren Beziehungen zur Funktion. Erste Mitteilung: Die modellierenden und formerhaltenden Faktoren des Knorpelreliefs. Z Anat Entwickl Gesch 76, 43-63.
- Bergmann, G., Siraky, J. und Rohlmann, A. (1984): A comparison of hip joint forces in sheep, dog and man. J Biomech 17 (12), 907-921.
- Böhmisch, R. (1998): Anatomische Untersuchungen zur funktionellen Morphologie des Schultergelenkes (Articulatio humeri) des Pferdes. Diss med vet, München.
- Böttcher, P., Maierl, J. und Liebich, H.-G. (1999): Measurement of subchondral bone density and cartilage thickness in the distal interphalangeal articulation of the horse. Tierärztl Prax 27 (5), 81.
- Braden, T. D. und Prieur, W. D. (1992): Three-plane intertrochanteric osteotomy for treatment of early stage hip dysplasia. Vet Clin North Am Small Anim Pract 22 (3), 623-643.
- Brown, T. D. und Shaw, D. T. (1983): In vitro contact stress distributions in the natural human hip. J Biomech 16 (6), 373-384.
- Budras, K.-D., Fricke, W. und Richter, R. (2000): Atlas der Anatomie des Hundes: Lehrbuch für Tierärzte und Studierende. Schültersche, Hannover.
- Budsberg, S. C., Verstraete, M. C. und Soutas-Little, R. W. (1987): Force plate analysis of the walking gait in healthy dogs. Am J Vet Res 48 (6), 915-918.
- Bullough, P. und Goodfellow, J. (1968): The significance of the fine structure of articular cartilage. J Bone Joint Surg Br 50 (4), 852-857.
- Bullough, P., Goodfellow, J. und O'Connor, J. (1973): The relationship between degenerative changes and load-bearing in the human hip. J Bone Joint Surg Br 55 (4), 746-758.
- Bullough, P. G., Goodfellow, J., Greenwald, A. S. und O'Connor, J. (1968): Incongruent surfaces in the human hip joint. Nature 217, 1290.
- Cardinet, G. H., Kass, P. H., Wallace, L. J. und Guffy, M. M. (1997): Association between the pelvic muscle mass and canine hip dysplasia. J Am Vet Med Assoc 210 (10), 1466-1473.
- Carter, D. R., Rapperport, D. J., Fyhrie, D. P. und Schurman, D. J. (1987): Relation of coxarthrosis to stresses and morphogenesis. A finite element analysis. Acta Orthop Scand 58, 611-619.
- Dalstra, M. und Huiskes, R. (1995): Load transfer across the pelvic bone. J Biomech 28 (6), 715-724.
- Day, W. H., Svanson, S. A. V. und Freeman, M. A. R. (1975): Contact pressures in the loaded human cadaver hip. J Bone Joint Surg Br 57, 302-313.
- DeCamp, C. E., Soutas-Little, R. W. und Hauptman, J. (1993): Kinematic gait analysis of the trot in healthy Greyhounds. Am J Vet Res 54, 627-634.
- Dickomeit, M. (2002): Anatomische und biomechanische Untersuchungen zum Ellbogengelenk des Hundes (Canis familiaris). Diss med vet, München.
- Dogan, S., Vanderby, R., Jr., Manley, P. A., Belloli, D. M., Hartman, L. und McBeath, A. A. (1989): Kinetic analysis of canine gait before and after total hip replacement. J Biomech 22 (10), 1004.
- Dueland, R., Bartel, D. L. und Antonson, E. (1977): Force-plate technique for canine gait analysis of total hip and excision arthroplasty. J Am Anim Hosp Assoc 13 (5), 547-552.
- Dueland, R. (1980): Femoral torsion and its possible relationship to canine hip dysplasia. Vet Surg 9, 48.
- Dyce, K. M., Sack, W. O. und Wensing, C. J. G. (1991): Anatomie der Haustiere. Enke, Stuttgart.
- Eckholm, R. und Ingelmark, B. E. (1952): Functional thickness variations of human articular cartilage. Acta Soc Med Ups 57, 39-59.
- Eckstein, F., Müller-Gerbl, M. und Putz, R. (1992): Distribution of subchondral bone density and cartilage thickness in the human patella. J Anat 180, 425-433.
- Eckstein, F., Löhe, F., Schulte, E., Müller-Gerbl, M., Milz, S. und Putz, R. (1993): Physiological incongruity of the humero-ulnar joint: a functional principle of optimized stress distribution acting upon articulating surfaces. Anat Embryol 188, 449-455.
- Eckstein, F., Steinlechner, M., Müller-Gerbl, M. und Putz, R. (1993a): Mechanische Beanspruchung und subchondrale Mineralisierung des menschlichen Ellbogengelenks. Unfallchirurg 96, 99-104.
- Eckstein, F., Löhe, F., Steinlechner, M., Müller-Gerbl, M. und Putz, R. (1993b): Kontaktflächen des menschlichen Humeroulnargelenks in Abhängigkeit von der Anpresskraft - ihr Zusammenhang mit subchondraler Mineralisierung und Gelenkmorphologie der Incisura trochlearis. Ann Anat 175, 545-552.
- Eckstein, F., Löhe, F., Müller-Gerbl, M., Steinlechner, M. und Putz, R. (1994a): Stress distribution in the trochlear notch. A model of bicentric load transmission through joints. J Bone Joint Surg Br 76 (4), 647-653.
- Eckstein, F., Merz, B., Schmid, P. und Putz, R. (1994b): The influence of geometry on the stress distribution in joints - a finite element analysis. Anat Embryol 189, 545-552.
- Eckstein, F., Löhe, F., Hillebrand, S., Bergman, M., Schulte, E., Milz, S. und Putz, R. (1995a): Morphomechanics of the humero-ulnar joint: I. Joint space width and contact areas as a function of load and flexion angle. Anat Rec 243, 318-326.
- Eckstein, F., Müller-Gerbl, M., Steinlechner, M., Kierse, R. und Putz, R. (1995c): Subchondral bone density in the human elbow assessed by computed tomography osteoabsorptiometry: a reflection of the loading history of the joint surface. J Orthop Res 13, 268-278.
- Eckstein, F., Fischer, K., Becker, C. und Putz, R. (1997a): Dichte-basierte mathematische Analyse der längerfristigen Beanspruchung des Hüftgelenks aus CTDaten. Osteologie 6 (Suppl. 1), 53.
- Eckstein, F., Jacobs, C. R. und Merz, B. (1997b): Mechanobiological adaptation of subchondral bone as a function of joint incongruity and loading. Med Eng Phys 19 (8), 720-8.
- Eckstein, F., Merz, B., Jacobs, C. R., Schön, M. und Putz, R. (1997c): Zugspannungen bestimmen die funktionelle Anpassung des subchondralen Knochens in inkongruenten Gelenken. Osteologie 6 (Suppl. 1), 30.
- Eckstein, F., v. Eisenhart-Rothe, R., Landgraf, J., Adam, C., Loehe, F., Müller-Gerbl, M. und Putz, R. (1997d): Quantitative analysis of incongruity, contact areas and cartilage thickness in the human hip joint. Acta Anat 158, 192-204.
- Eckstein, F., Merz, B., Schön, M., Jacobs, C. R. und Putz, R. (1999): Tension and bending, but not compression alone determine the functional adaptation of subchondral bone in incongruous joints. Anat Embryol 199 (1), 85-97.
- Eisenhart-Rothe, R. v., Eckstein, F., Landgraf, J., Löhe, F., Müller-Gerbl, M. und Putz, R. (1996): Verteilung der anatomischen Gelenkspaltweite und Flächenpressung im menschlichen Hüftgelenk- eine quantitative Analyse. Osteologie 5, 55-64.
- Eisenhart-Rothe, R. v., Eckstein, F., Müller-Gerbl, M., Landgraf, J., Rock, C. und Putz, R. (1997): Direct comparison of contact areas, contact stress and subchondral mineralization in human hip joint specimens. Anat Embryol 195, 279-288.
- Eisenhart-Rothe, R. v., Witte, H., Steinlechner, M., Müller-Gerbl, M., Putz, R. und Eckstein, F. (1999): Quantitative Bestimmung der Druckverteilung im Hüftgelenk während des Gangzyklus. Unfallchirurg 102, 625-631.
- Eller, D. (2003): Anatomische und biomechanische Untersuchungen am Schultergelenk (Articulatio humeri) des Hundes (Canis familiaris). Diss med vet, München.
- Evans, H. E. (1993a): Arthrology. In: H. E. Evans, Ed., Miller's Anatomy of the Dog, 3rd ed. W. B. Saunders, Philadelphia.
- Evans, H. E. (1993b): The Skeleton. In: H. E. Evans, Ed., Miller's Anatomy of the Dog, 3rd ed. W. B. Saunders, Philadelphia.
- Frewein, J. (1994): Muskulatur. In: J. Frewein und B. Vollmerhaus, Eds., Anatomie von Hund und Katze. Blackwell-Wiss.-Verlag, Berlin.
- Fries, C. L. und Remedios, A. M. (1995): The pathogenesis and diagnosis of canine hip dysplasia: A review. Can Vet J 36, 494-502.
- Goodfellow, J. und Bullough, P. (1968): Studies on age changes in the human hip joint. J Bone Joint Surg Br 50, 222.
- Goodfellow, J. und Mitsou, A. (1977): Joint surface incongruity and its maintenance. J Bone Joint Surg Br 59, 446-451.
- Greenwald, A. S. und O'Connor, J. J. (1971): The transmission of load through the human hip joint. J Biomech 4, 507-528.
- Greenwald, A. S. und Haynes, W. C. (1972): Weight-bearing areas in the human hip joint. J Bone Joint Surg Br 54, 157-163.
- Habermehl, K.-H. (1961): Altersbestimmung bei Haustieren, Pelztieren und beim jagdbaren Wild. Parey, Berlin.
- Hauptman, J. und Butler, H. C. (1980): Measurements of femoral neck - shaft angle in the growing beagle. Vet Surg 9, 39-41.
- Hauptman, J., Cardinet, C. H., Morgan, J. P., Guffy, M. M. und Wallace, L. J. (1985): Angles of inclination and anteversion in hip dysplasia in the dog. Am J Vet Res 46 (10), 2033-2036.
- Hayes, W. C. und Bodine, A. J. (1978): Flow-independent viscoelastic properties of articular cartilage matrix. J Biomech 11, 407-419.
- Henschel, E. (1983): Das Hüftgelenk von Hund und Katze - eine Enarthrosis? Tierärztl Prax 11, 345-348.
- Hermanson, J. W. und Evans, H. E. (1993): The muscular system. In: H. E. Evans, Ed., Miller's anatomy of the dog, 3rd ed. W. B. Saunders, Philadelphia.
- Heyman, S. J., Smith, G. K. und Cofone, M. A. (1993): Biomechanical study of the effect of coxofemoral positioning on passive hip joint laxity in dogs. Am J Vet Res 54 (2), 210-215.
- Hultkrantz, W. (1898): Über die Spaltrichtungen der Gelenkknorpel. Verh Anat Ges 12, 248-256.
- Hutton, W. C. und England, J. P. S. (1969): The femoral head prosthesis and the dog. J Small Anim Pract 10, 79-85.
- Hutton, W. C., Freeman, M. A. R. und Swanson, S. A. V. (1969): The forces exerted by the pads of the walking dog. J Small Anim Pract 10, 71-77.
- Ingelmark, B. E. und Eckholm, R. (1948): A study on variations in the thickness of articular cartilage in association with rest and periodical load. An experimental investigation on rabbits. Acta Soc Med Ups 53, 61-74.
- Jacobs, C. R. und Eckstein, F. (1997): Computer simulation of subchondral bone adaptation to mechanical loading in an incongruous joint. Anat Rec 249 (3), 317-326.
- Kaser, W. (1998): Untersuchungen zur funktionellen Anatomie des Ellbogengelenkes (Articulatio cubiti) des Hundes. Diss med vet, München.
- Konermann, H. (1971): Funktionelle Analyse der Knorpelstruktur des Talonaviculargelenks. Z Anat Entwickl Gesch 133, 1-36.
- Köppel, E. (1991): Zur Entwicklung der Articulatio coxae und radiologischen Frühdiagnostik der Hüftgelenkdysplasie des Hundes. Enke, Stuttgart.
- Körbel, J. (2000): Ellbogengelenkdysplasie des Hundes - eine computertomographische und CT-osteoabsorptiometrische Studie. Diss med vet, München.
- Kummer, B. (1962): Funktioneller Bau und funktionelle Anpassung des Knochens. Anat Anz 111, 261-293.
- Kummer, B. (1968): Die Beanspruchung des menschlichen Hüftgelenks. I. Allgemeine Problematik. Z Anat Entwickl Gesch 127, 277-285.
- Kummer, B., Breul, R., Strauss, M. und Lohscheidt, K. (1987): Spannungsverteilung über Kugelgelenkflächen. Verh Anat Ges 81, 445-446.
- Küpper, W. (1980): Die Biomechanik des Hüft- und Schultergelenkes beim Hund - zum Aussagewert von Tierversuchen bei der experimentellen Erprobung menschlicher Endoprothesen im Tiermodell. Dtsch tierärztl Wschr 88, 146.
- Küpper, W., Müller, B., Heim, U., Thissen, H. J. und Walla, L. (1989): Die Pfannendachplastik nach SERTL zur operativen Behandlung der Hüftgelenksdysplasie beim Hund. Kleintierpraxis 34, 357-360.
- Larché, W. D. (1962): Der Einfluß mechanischer und funktioneller Faktoren auf das Angehen des Hundes. Diss med vet, Gießen.
- Liebich, H.-G. (1999): Binde- und Stützgewebe. In: H.-G. Liebich, Ed., Funktionelle Histologie der Haussäugetiere, 3. Aufl. Schattauer, Stuttgart.
- Liebich, H.-G. und König, H. E. (2001): Hinter- und Beckengliedmaßen. In: H. E. König und H.-G. Liebich, Eds., Anatomie der Haussäugetiere, Bd. I. Schattauer, Stuttgart.
- Löer, B. (1999): Computertomographische Torsionsmessung an Femur und Tibia des Hundes - Methode und klinische Anwendung bei der Luxatio patellae congenita. Diss med vet, München.
- Löhe, F., Eckstein, F., Sauer, T. und Putz, R. (1996): Structure, strain and function of the transverse acetabular ligament. Acta Anat 157, 315-323.
- Lott, D. (1988): Zur Bestimmung der Gelenkwinkel an den Gliedmaßen von Hunden. Diss med vet, Berlin.
- Mahringer, C. (1991): Längen- und Winkelverhältnisse am proximalen Femurende des Hundes und deren biomechanische Aspekte. Diss med vet, Wien.
- Maierl, J., Gutmannsbauer, B., Böttcher, P., Liebich, H.-G. und Matis, U. (1998a): CTOsteoabsorptiometry in the canine shoulder joint - a new method to assess long-term loading. In: J.-F. Bardet, Ed., 9th Annual ESVOT Congress, 16.- 19.04.1998, München.
- Maierl, J., Kaser, W., Müller-Gerbl, M., Putz, R. und Liebich, H.-G. (1998b): CTOsteoabsorptiometry in the canine elbow joint - a new method to assess the loading history. Anat. Histol. Embryol. 27 (6), 432.
- Maierl, J. und Böttcher, P. (1999): Dreidimensionale Visualisierung der subchondralen Knochendichte entlang der Oberflächennormalen am Schulter- und Ellbogengelenk des Hundes. Ann Anat 181 (suppl), 288.
- Maierl, J., Böttcher, P. und Liebich, H.-G. (1999): Is the elbow joint of the dog really congruous? Tierärztl. Prax. 27 (5), 79.
- Maierl, J., Böttcher, P., Rigl, S. und Liebich, H.-G. (2000a): Subchondral bone density in the canine hip joint, XXIII Congress of the European Association of Veterinary Anatomists, 16.-19. July 2000, Olsztyn.
- Maierl, J., Misof, F., Böttcher, P. und Liebich, H.-G. (2000b): Knochendichte und Knorpeldicke am Schultergelenk des adulten Hundes. Ann. Anat. (suppl.) 182, 191- 192.
- Maierl, J., Schäfer, C., Böttcher, P. und Liebich, H.-G. (2001): Die subchondrale Knochendichte am Fesselgelenk des Pferdes. Teil 1: Computertomographische Osteoabsorptiometrie (CT-OAM). Pferdeheilkunde 17 (4), 339-345.
- Mankin, H. J. (1985): The articular cartilages. In: C. D. Newton und D. M. Nunamaker, Eds., Textbook of small animal orthopaedics. J. B. Lippincott, Philadelphia.
- Manley, P. A. (1993): The hip joint. In: D. H. Slatter, Ed., Textbook of small animal surgery, 1786-1804. W.B. Saunders, Philadelphia.
- Meachim, G., Denham, D., Emery, I. H. und Wilkinson, P. H. (1974): Collagen alignments and artificial splits at the surface of human articular cartilage. J Anat 118 (1), 101-118.
- Milz, S. und Putz, R. (1994): Quantitative morphology of the subchondral plate of the tibial plateau. J Anat 185, 103-110.
- Misof, F., Maierl, J., Böttcher, P. und Liebich, H.-G. (1999): Biomechanical aspects of the canine shoulder joint. Tierärztl Prax 27 (5), 78.
- Molzberger, H. (1973): Die Beanspruchung des menschlichen Hüftgelenks. IV. Analyse der funktionellen Struktur der Tangentialfaserschicht des Hüftpfannenknorpels. Z Anat Entwickl Gesch 139, 283-306.
- Montavon, P. M., Hohn, R. B., Olmstead, M. L. und Rudy, R. L. (1985): Inclination and anteversion angles of the femoral head and neck in the dog. Evaluation of a standard method of measurement. Vet Surg 14 (4), 277-282.
- Montavon, P. M. (1992): Morphometry and static biomechanical analysis of the canine hip joint: Application to a colony of English Foxhounds. Habilitationsschrift, Zürich.
- Montgomery, R. D., Milton, J. L., Pernell, R. und Aberman, H. M. (1992): Total hip arthroplasty for treatment of canine hip dysplasia. Vet Clin North Am Small Anim Pract 22 (3), 703-719.
- Mow, V. C., Kuei, S. C., Lai, W. M. und Armstrong, C. G. (1980): Biphasic creep and stress relaxation of articular cartilage in compression: Theory and experiments. J Biomech Eng 102, 73-84.
- Muir, H. (1995): The chondrocyte, architect of cartilage. Biomechanics, structure, function and molecular biology of cartilage matrix macromolecules. BioEssays 17 (12), 1039-1048.
- Müller-Gerbl, M., Putz, R. und Schulte, E. (1988): Zur Verteilung der Knorpeldicke und der subchondralen Knochendichte in der Cavitas glenoidalis. Verh Anat Ges 82, 393-394.
- Müller-Gerbl, M., Putz, R., Hodapp, N., Schulte, E. und Wimmer, B. (1989): Computed tomography-osteoabsorptiometry for assessing the density distribution of subchondral bone as a measure of long-term mechanical adaptation in individual joints. Skeletal Radiol 18, 507-512.
- Müller-Gerbl, M., Putz, R., Hodapp, N., Schulte, E. und Wimmer, B. (1990): Die Darstellung der subchondralen Dichtemuster mittels der CT-Osteoabsorptiometrie (CT-OAM) zur Beurteilung der individuellen Gelenkbeanspruchung am Lebenden. Z Orthop 128, 128-133.
- Müller-Gerbl, M., Putz, R. und Kenn, R. (1992): Demonstration of subchondral bone density patterns by three dimensional CT osteoabsorptiometry as a noninvasive method for in vivo assessment of individual long term stresses in joints. J Bone Miner Res 7 (Suppl. 2), 411-418.
- Müller-Gerbl, M. und Putz, R. (1993): Zur Morphologie und Mechanik der Gelenke in Abhängigkeit vom Lebensalter. In: H. J. Pesch, H. Stöß und B. Kummer, Eds., Osteologie Aktuell VII. Springer, Berlin.
- Müller-Gerbl, M., Putz, R. und Kenn, R. (1993a): Verteilungsmuster der subchondralen Mineralisierung in der Cavitas glenoidalis bei Normalpersonen, Sportlern und Patienten. Z Orthop 131, 10-13.
- Müller-Gerbl, M., Putz, R., Kenn, R., Beyer, W., Hirschfelder, H. und Täger, K. H. (1993b): Reaction of the subchondral bone to the changes in mechanical stress in the knee joint following osteotomy. J Biomech 7, 883.
- Müller-Gerbl, M., Putz, R., Kenn, R. und Kierse, R. (1993c): People in different age groups show different hip joint morphology. Clin Biomech 8, 66-72.
- Newton, C. D. (1985): Normal joint range of motion in the dog and cat, Appendix B. In: C. D. Newton und D. M. Nunamaker, Eds., Textbook of small animal orthopaedics, 1101-1106. J. B. Lippincott, Philadelphia.
- Nickel, R., Schummer, A., Wille, K.-H. und Wilkens, H. (1992): Passiver Bewegungsapparat, Skelettsystem. In: R. Nickel, A. Schummer und E. Seiferle, Eds., Lehrbuch der Anatomie der Haustiere, Bd. I, 6. Aufl. Parey, Berlin.
- Nunamaker, D. M., Biery, D. N. und Newton, C. D. (1973): Femoral neck anteversion in the dog: its radiographic measurement. Am Vet Soc 14, 45-48.
- Nunamaker, D. M. (1974): Surgical correction of large femoral anteversion angles in the dog. J Am Vet Med Assoc 165 (12), 1061-1064.
- Oberländer, W. (1973): Die Beanspruchung des menschlichen Hüftgelenks. V. Die Verteilung der Knochendichte im Acetabulum. Z Anat Entwickl Gesch 140, 367- 384.
- Off, W. und Matis, U. (1997a): Ganganalyse beim Hund. Teil 2: Aufbau eines Ganglabors und bewegungsanalytische Untersuchungen. Tierärztl Prax 25, 303-311.
- Off, W. und Matis, U. (1997b): Resektionsarthroplastik des Hüftgelenkes bei Hunden und Katzen. Tierärztl Prax 25, 379-387.
- Page, A. E., Allan, C., Jasty, M., Harrigan, T. P., Bragdon, C. R. und Harris, W. H. (1993): Determination of loading parameters in the canine hip in vivo. J Biomech 26 (4/5), 571-579.
- Pauwels, F. (1959): Die Struktur der Tangentialfaserschicht des Gelenkknorpels der Schulterpfanne als Beispiel für ein verkörpertes Spannungsfeld. Z Anat Entwickl Gesch 121, 188-240.
- Pauwels, F. (1960): Eine neue Theorie über den Einfluß mechanischer Reize auf die Differenzierung der Stützgewebe. Zehnter Beitrag zur funktionellen Anatomie und kausalen Morphologie des Stützapparates. Z Anat Entwickl Gesch 121, 478-515/480-518.
- Pauwels, F. (1961): Neue Richtlinien für die operative Behandlung der Koxarthrose, Verh Dtsch Orthop Ges 48. Kongr.
- Pauwels, F. (1965): Gesammelte Abhandlungen zur funktionellen Anatomie des Bewegungsapparates. Springer, Berlin.
- Pauwels, F. (1973): Atlas zur Biomechanik der gesunden und kranken Hüfte. Prinzipien, Technik und Resultate einer kausalen Therapie. Springer, Berlin.
- Pauwels, F. (1980): Biomechanics of the locomotor apparatus. Springer, Berlin.
- Prieur, W. D. (1980): Coxarthrosis in the dog part I: Normal and abnormal biomechanics of the hip joint. Vet Surg 9, 145-149.
- Remedios, A. M. und Fries, C. L. (1995): Treatment of canine hip dysplasia: A review. Can Vet J 36, 503-509.
- Richter, V. und Loeffler, K. (1976): Rassespezifische Merkmale am Becken des Hundes. Dtsch Tierärztl Wschr 83, 455-461.
- Richter, V. (1977): Untersuchungen am Becken des Hundes unter besonderer Berücksichtigung des Hüftgelenkes und rassespezifischer Merkmale. Diss med vet, München.
- Riser, W. H. und Shirer, J. F. (1966): Hip dysplasia: coxofemoral abnormalities in neonatal German shepard dogs. J Small Anim Pract 7, 7-12.
- Riser, W. H. (1973a): Growth and development of the normal canine pelvis, hip joints and femurs from birth to maturity: A radiographic study. J Am Vet Rad Soc 14 (2), 24-34.
- Riser, W. H. (1973b): The dysplastic hip joint: Its radiographic and histologic development. J Am Vet Rad Soc 14 (2), 35-50.
- Riser, W. H., Rhodes, W. H. und Newton, C. D. (1985): Hip dysplasia. In: C. D. Newton und D. M. Nunamaker, Eds., Textbook of small animal orthopaedics, 953-980. J. B. Lippincott, Philadelphia.
- Schawalder, P. und Sterchi, H. P. (1981a): Der Centrum-Collum-Diaphysenwinkel (CC'D) und der Antetorsionswinkel (AT) beim Hund. Kleintierpraxis 26, 151-162.
- Schawalder, P. und Sterchi, H. P. (1981b): Der Centrum-Collum-Diaphysenwinkel (CC'D) und der Antetorsionswinkel (AT) beim Hund. II. Mitteilung: Korrelation zwischen dem CC'D und dem AT. Röntgendiagnostische Aspekte. Kleintierpraxis 26, 273-278.
- Schawalder, P., Spreng, D., Dietschi, E., Dolf, G. und Gaillard, C. (1996): Beitrag zur Biomechanik des Hüftgelenks mit neuen diagnostischen Aspekten im Umfeld der Hüftgelenkdysplasie. Teil I. Schweiz Arch Tierheilk 138 (11), 511-522.
- Schawalder, P., Spreng, D., Dietschi, E., Dolf, G. und Gaillard, C. (1997): Beitrag zur Biomechanik des Hüftgelenks mit neuen diagnostischen Aspekten im Umfeld der Hüftgelenkdysplasie. Teil II. Schweiz Arch Tierheilk 139 (6), 265-270.
- Schön, M., Eckstein, F., Vogt, S., Huber, W. und Putz, R. (1998): Subchondrale Spaltlinien des menschlichen Ellbogen- und Kniegelenkes - Ausdruck der Biegung und Zugbeanspruchung des subchondralen Knochens? Osteologie 7 (2), 77-87.
- Seiferle, E. und Frewein, J. (1992): Aktiver Bewegungsapparat, Muskelsystem, Myologia. In: R. Nickel, A. Schummer und E. Seiferle, Eds., Lehrbuch der Anatomie der Haustiere, Bd. I, 6. Aufl. Parey, Berlin.
- Setton, L. A., Zhu, W. und Mow, V. C. (1993): The biphasic poroviscoelastic behavior of articular cartilage: role of the surface zone in governing the compressive behavior. J Biomech 26 (4/5), 581-592.
- Shahar, R. und Milgram, J. (2001): Morphometric and anatomic study of the hind limb of a dog. Am J Vet Res 62 (6), 928-933.
- Shahar, R. und Banks-Sills, L. (2002): Biomechanical analysis of the canine hind limb: Calculation of forces during three-legged stance. Vet J 163, 240-250.
- Shively, M. J. und Van Sickle, D. C. (1982): Developing coxal joint of the dog: Gross morphometric and pathologic observations. Am J Vet Res 42 (2), 185-194.
- Slocum, B. und Slocum, T. D. (1992): Pelvic osteotomy for axial rotation of the acetabular segment in dogs with hip dysplasia. Vet Clin North Am Small Anim Pract 22 (3), 645-682.
- Smith, G. K., Biery, D. N. und Gregor, T. P. (1990): New concepts of coxofemoral joint stability and the development of a clinical stress-radiographic method for quantitating hip joint laxity in the dog. J Am Vet Med Assoc 196 (1), 59-70.
- Smith, R. N. (1963): The normal and radiological anatomy of the hip joint of the dog. J Small Anim Pract 4, 1-9.
- Stampfer, R., Scheurer, K. und Müller-Gerbl, M. (1999): Subchondrale Mineralisierungsmuster bei kongenitaler Hüftdysplasie vor und nach Umstellungsosteotomie. Ann Anat 181, 154.
- Staszyk, C. und Gasse, H. (2002): Zur Innervation der Gelenkkapseln beim Hund. Teil 3: Hüftgelenk. Kleintierpraxis 47, 11-17.
- Sterchi, H. P. (1980): Winkelbestimmungen am proximalen Femurende. Beitrag zur Hüftgelenkbiomechanik des Hundes. Diss med vet, Bern.
- Stubbs, W. P., Lewis, D. D., Miller, G. J., Quarterman, C. und Hosgood, G. (1998): A biomechanical evaluation and assessment of the accuracy of reduction of two methods of acetabular osteotomy fixation in dogs. Vet Surg (27), 429-437.
- Tillmann, B. (1969): Die Beanspruchung des menschlichen Hüftgelenks. III. Die Form der Facies lunata. Z Anat Entwickl Gesch 128, 329-349.
- Tillmann, B. (1971): Die Beanspruchung des menschlichen Ellbogengelenks. I. Funktionelle Morphologie der Gelenkflächen. Z Anat Entwickl Gesch 134, 328-342.
- Tillmann, B. (1973): Zur Lokalisation von degenerativen Veränderungen am Femurkopf bei der Coxarthrose. Z Orthop 111, 23-27.
- Tillmann, B. (1978a): A contribution to the functional morphology of articular surfaces. In: W. Bargmann und W. Doerr, Eds., Normale und Pathologische Anatomie, 34, 1-50. Thieme, Stuttgart.
- Tillmann, B. (1978b): Zur Lokalisation und funktionellen Deutung degenerativer Frühveränderungen am Gelenkknorpel. Z Orthop 116, 430.
- Vogt, S., Eckstein, F., Schön, M. und Putz, R. (1999a): Vorzugsrichtung der Kollagenfibrillen im subchondralen Knochen des Hüft- und Schultergelenks. Ann Anat 181, 181-189.
- Vogt, S., Schön, M., Eckstein, F., Eisenhart-Rothe, R. v. und Putz, R. (1999b): Subchondrale Spaltlinienmuster als Ausdruck einer Biege- und Zugbeanspruchung im subchondralen Knochen in den konkaven Anteilen synovialer Gelenke. Ann Anat 181, 155.
- Vollmerhaus, B., Frewein, J., Roos, H. und Knospe, C. (1994a): Skelett. In: J. Frewein und B. Vollmerhaus, Eds., Anatomie von Hund und Katze. Blackwell-Wiss.- Verl., Berlin.
- Vollmerhaus, B., Waibl, H. und Roos, H. (1994b): Gelenke. In: J. Frewein und B. Vollmerhaus, Eds., Anatomie von Hund und Katze. Blackwell-Wiss.-Verl., Berlin.
- Waibl, H. (1988): Zur angewandten Anatomie des Hüftgelenkes beim Hund. Tierärztl Prax 16, 83-86.
- Wegener, O. H. (1996): Grundkurs Computertomographie. Blackwell Wiss.-Verl., Berlin.
- Weigel, J. P. und Wasserman, J. F. (1992): Biomechanics of the normal and abnormal hip joint. Vet Clin North Am Small Anim Pract 22 (3), 513-528.
- Wolff, J. (1892): Das Gesetz der Transformation der Knochen. Springer, Berlin.
Danksagung
Herrn Prof. Dr. Dr. h.c. mult. H.-G. Liebich danke ich für die Überlassung des
Dissertationsthemas, die Bereitstellung aller technischen Einrichtungen des Instituts
sowie für die hervorragenden Arbeitsbedingungen.
Herrn Dr. J. Maierl danke ich herzlich für die wissenschaftliche Betreuung und für seine Unterstützung bei allen Fragen und Problemen der Dissertation.
Frau Prof. Dr. U. Matis danke ich für die Bereitstellung des Computertomographen der Chirurgischen Tierklinik der LMU München.
Frau S. Mitterer danke ich für die moralische Unterstützung, ihre wertvollen Anregungen und ihrer Hilfe bei der Durchsicht dieser Arbeit.
Darüber hinaus danke ich den Präparatoren, Herrn H. Kelm, Herrn H. Obermayer und Herrn S. Hecher für ihre ausdauernde Hilfe bei der Sichtung und Präparation des Untersuchungsgutes.
Bei Herrn Dr. P. Böttcher bedanke ich mich für die prompte Hilfe in computertechnischen Problemfällen.
Ebenso möchte ich mich bei allen Mitarbeitern des Instituts für Tieranatomie I bedanken, die mir stets mit Rat und Tat zur Seite standen.
Mein besonderer Dank gilt meinen Eltern, die mir das Studium ermöglichten, und meinem Freund Thomas, für seine unermüdliche Geduld und Unterstützung.
Lebenslauf
| Name | Birgit Ulrike Lieser |
| 12.12.1972 | geboren in Schongau |
| 1979-1983 | Grundschule Schongau |
| 1983-1992 | Gymnasium Schongau |
| 1992-1993 | Auslandsjahr in Spanien und den USA |
| 1993-1995 | Studium der Anglistik und Germanistik an der Ludwig Maximilians-Universität München |
| 1995-2001 | Studium der Tiermedizin an der Ludwig-Maximilians- Universität München |
| Februar 2001 | Approbation |
| Mai 2001 | Doktorandin am Institut für Tieranatomie I der |
| bis April 2003 | Tierärztlichen Fakultät der Ludwig-Maximilians- Universität München |